
科目: 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示。下列说法不正确的是
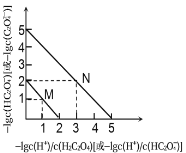
A. Ka1(H2C2O4)的数量级为10-2
B. 曲线M表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系
C. 向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,此时溶液pH约为5
D. 在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分是Al2O33H2O,还含有SiO2、Fe2O3等杂质。工业上从铝土矿中提取Al可采用如图所示工艺流程。(部分操作名称及反应条件已略去)

(1)B是___,X是___,若将盐酸与X互换,则B是___。
(2)生成C的离子方程式是___。
(3)D中的溶质是___,通入CO2后生成F的化学方程式是___,F的一种用途是___。
(4)由M生成铝的化学方程式是___,当有5.4g铝生成时,转移电子___mol。
(5)上述流程中的CO2能否用盐酸代替?理由是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,将SO2通入Na2CO3和Na2S混合溶液中可制得Na2S2O3。其制备装置如图所示。

(1)A中反应的化学方程式为_____。
(2)为保证Na2S和Na2CO3得到充分利用,两者的物质的量之比应为____。
(3)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是___。
(4)待Na2S和Na2CO3完全消耗后,结束反应。过滤B中的混合物,滤液经过__、___(填操作名称)、过滤、洗涤、干燥,得到Na2S2O35H2O晶体。
(5)称取10.0g产品(Na2S2O35H2O,相对分子质量为248),配成250mL溶液,取25.00mL溶液,以淀粉作指示剂,用 0.1000 mol/L碘的标准溶液滴定。(反应原理为:2S2O32-+I2 = S4O62-+2I-,忽略Na2SO3与I2反应)。
①滴定终点的现象为____。
②重复三次的实验数据如表所示,其中第三次读数时滴定管中起始和终点的液面位置如图所示,则x=____,产品的纯度为__。


查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
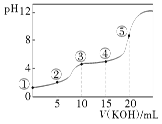
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃条件下,用0.1molL-1的一元弱酸HR[已知:25℃时,Ka(HR)=1.7×10-5]溶液滴定10.00mL0.1molL-1一元碱MOH溶液,滴定过程中HR溶液的体积与溶液中lg![]() 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )

A.25℃时,0.1molL-1的MOH溶液pH<13
B.a点消耗HR溶液的体积等于10.00mL
C.b点溶液中c(R-)>c(H+)>c(M+)>c(OH-)
D.25℃时,MR溶液中![]() =
=![]() ×10-9
×10-9
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下反应H2(g)+I2(g)![]() 2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
2HI(g)的平衡常数K=57.0,现向此温度下的真空容器中充入0.2 mol·L1H2(g)、0.5mol·L1 I2(g)及0.3mol·L1HI(g),则下列说法中正确的是
A.反应正好达到平衡
B.反应向左进行
C.反应向某方向进行一段时间后K<57.0
D.反应向某方向进行一段时间后c(H2)<0.2mol·L1
查看答案和解析>>
科目: 来源: 题型:
【题目】铝土矿的主要成分是Al2O33H2O,还含有SiO2、Fe2O3等杂质。工业上从铝土矿中提取Al可采用如图所示工艺流程。(部分操作名称及反应条件已略去)

(1)A中的阳离子是___。
(2)写出下列物质的化学式:B___,X___,F___。
(3)由M生成铝的化学方程式是_______,其中冰晶石的作用是___,当有1mol铝生成时,转移电子___mol。
(4)沉淀C受热分解的化学方程式是___。
(5)铝可以与C分解生成的金属氧化物反应,其化学方程式是___,该反应可用于___。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学用如图所示的电化学装置电解硫酸铜溶液,有一个电极为Al,其它三个电极均为Cu,则下列说法正确的是( )

A.电子方向:电极Ⅳ→→电极ⅠB.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解D.电极Ⅲ的电极反应:Cu-2e-═Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.充电时,蓄电池的负极应与外接电源正极相连
D.放电时负极附近溶液的碱性减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组的同学们通过以下实验探究乙醇的化学性质。

(1)乙醇的官能团是___(写名称)。
(2)实验Ⅰ中观察到的现象是___,有关反应的化学方程式是___。
(3)向实验Ⅱ的A试管内加入药品的先后顺序是___,加热后A试管内发生反应的化学方程式是___,该反应的类型是___。
(4)实验Ⅱ的B试管中盛放的液体是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com