
科目: 来源: 题型:
【题目】下列各组离子能在指定的环境下可以大量共存的是( )
A.在pH=0的溶液中:Na+、Fe2+、Cl-、![]()
B.由水电离出的c(H+)=1×10-14mol/L的溶液:K+、![]() 、Cl-、
、Cl-、![]()
C.c(H+)<c(OH-)溶液:Na+、K+、![]() 、
、![]()
D.PH=2的一元酸和PH=12的一元强碱等体积混合:c(OH-)=C(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】羟甲香豆素是一种治疗胆结石的药物。其部分合成工艺如下:
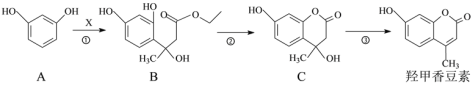
(1)已知![]() 不能稳定存在。反应①中X的分子式为C6H10O3,则X的结构简式为________。
不能稳定存在。反应①中X的分子式为C6H10O3,则X的结构简式为________。
(2)反应①、②的反应类型分别为________、________。
(3)下列有关说法正确的是________。
A.化合物B和C分子各含有1个手性碳原子
B.化合物C能发生加成反应、取代反应和消去反应
C.1 mol羟甲香豆素最多可与2 mol NaOH反应
(4)写出满足下列条件的化合物C的一种同分异构体的结构简式________。
①能发生水解反应,且水解产物之一能与FeCl3溶液发生显色反应;
②分子中只有2种不同化学环境的氢
(5)反应③的化学方程式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验过程中,下列溶液的导电能力变化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至过量
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入![]() 至过量
至过量
D. ![]() 溶液中加入适量的NaOH固体
溶液中加入适量的NaOH固体
查看答案和解析>>
科目: 来源: 题型:
【题目】H2C2O4是二元弱酸,常温下,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,下列溶液的离子浓度关系式正确的是( )
A.pH=2的H2C2O4溶液中,c(H+)=c(HC2O4-)=10-2molL-1
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
C.将NaOH溶液滴加到H2C2O4溶液中至混合溶液呈中性:c(C2O42-)>c(HC2O4-)
D.NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应4 NH3(g)+5O2(g)![]() 4NO(g)+6 H2O(g),下列叙述正确的是
4NO(g)+6 H2O(g),下列叙述正确的是
A.NH3和H2O化学反应速率关系是2v正(NH3)= 3v正(H2O)
B.达到化学平衡时,4v正(O2)= 5v逆(NO )
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.常温下,AgCl在同物质的量浓度的AgNO3和NaCl溶液中的溶解度比较,前者大
B.常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合后形成溶液a,等物质的量浓度的盐酸与NaOH溶液等体积混合后形成溶液b,水的电离程度a>b
C.若将适量CO2通入0.1molL-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化)2c(CO32-)+c(HCO3-)=0.1molL-1
D.常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:KaKh=Kw
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ:Mo基催化剂的耐硫甲烷化反应会涉及WGS 或者RWGS 反应,主要反应式如下:
(1)CO和CO2甲烷化 CO(g)+3H2(g)=CH4(g)+H2O(g) ΔH1=-206.2kJ/mol
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ΔH2=-165.0kJ/mol
写出CO 与水蒸气反应生成CO2和H2的热化学方程式__________________________________。
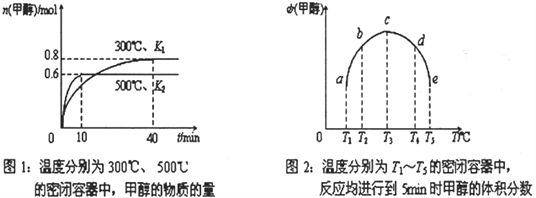
(2)CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g) ΔH。现在容积均为1L 的a、b、c、d、e 五个密闭容器中分别充入1molCO和2molH2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
 ,
,
①该反应的ΔH__________0 (选填“<”、“>”或“=”)。
②在500℃条件下达平衡时CO 的转化率为______________________。
③计算在300℃条件下达平衡时K=________________________。
④将容器d 中的平衡状态转变到容器c中的平衡状态,可采取的措施有______________________。
Ⅱ:某电解装置如图所示,X、Y 均为惰性电极:
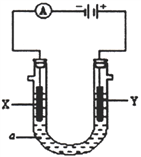
(3)若a溶液为滴有酚酞试液的NaNO3溶液,通电一段时间后X 电极及周围溶液的现象是:________________________________,Y 电极的电极反应式为______________________。
(4)若a 溶液为饱和CuCl2溶液,当电路中有0.2 mol 的电子通过时,阴、阳两电极的质量之差是__________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是
A.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.在2 s时,体系内压强为反应前的1.1倍
C.平衡时,体系内含N2O40.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72(橙色) + H2O![]() 2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )
2CrO42(黄色) + 2H+。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )

A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72被C2H5OH还原
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液内的血红蛋白(Hb)易与O2结合生成HbO2,因此具有输氧能力,CO吸入肺中发生反应:CO+HbO2![]() O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
O2+HbCO,37℃时,该反应的平衡常数K=220。HbCO的浓度达到HbO2浓度的0.02倍,会使人智力受损。据此,下列结论错误的是( )
A.CO与HbO2反应的平衡常数K=![]()
B.人体吸入的CO越多,与血红蛋白结合的O2越少
C.当吸入的CO与O2浓度之比大于或等于0.02时,人的智力才会受损
D.把CO中毒的病人放入高压氧仓中解毒,其原理是使上述平衡向左移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com