
科目: 来源: 题型:
【题目】氢镍电池是近年开发出的可充电电池,电池的总反应式为1/2 H2 + NiO(OH) ![]() Ni(OH)2 ,下列叙述正确的是( )
Ni(OH)2 ,下列叙述正确的是( )
A.电池充电时,Ni元素被还原B.电池放电时,镍元素被氧化
C.电池充电时,只有H元素被氧化D.电池放电时,氢气中氢元素被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A.邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构
B.高聚物![]() 的单体可以通过乙烯和HCl加成制得
的单体可以通过乙烯和HCl加成制得
C.(CH3)2CH﹣CH=CH﹣C(CH3)3与氢气加成后的产物用系统命名法命名为2,2,5﹣三甲基己烷
D.完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电解质溶液有关叙述正确的是
A.恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变
B.向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大
C.0.1mol/LNaHCO3溶液中,c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl 是难溶于水的白色固体,是一种重要的催化剂。工业上,由孔雀石(主要成分Cu(OH)2·CuCO3, 含FeS、FeO 和SiO2杂质)制备CuCl 的某流程如下

下列说法不正确的是
A.H2O2将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去
B.CO32-作用是控制溶液pH,促使CuCl 沉淀的生成
C.SO32-将溶液3 中的Cu2+还原,反应得到CuCl
D.若改变试剂加入顺序,将溶液3 缓慢加入到含大量SO32-/CO32-的溶液中,同样可制取CuCl
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,将
时,将![]() 的盐酸与b
的盐酸与b![]() 的氨水等体积混合,反应后溶液呈中性
的氨水等体积混合,反应后溶液呈中性![]() 忽略溶液混合后体积的变化
忽略溶液混合后体积的变化![]() 下列说法不正确的是
下列说法不正确的是![]()
A.此时水的电离程度并不是最大
B.混合溶液中的离子浓度:![]()
C.此时溶液中![]() 的浓度为
的浓度为![]()
D.用含b的代数式不能表示![]() 时
时![]() 的电离常数
的电离常数
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 时,将一定量的冰醋酸
时,将一定量的冰醋酸![]() 即无水乙酸
即无水乙酸![]() 加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是
加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法正确的是![]()
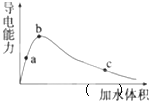
A.醋酸的电离平衡常数:![]()
B.溶液中![]() :
:![]()
C.a、b、c三点的溶液都有:![]()
D.从c点到b点,醋酸的电离度不断增大
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是( )
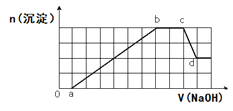
A.d点溶液中含有的溶质只有Na2SO4
B.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
C.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+、Na+
D.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的叙述错误的是

A. Oa段反应的化学方程式是Ba(OH)2+CO2 =BaCO3↓+H2O
B. bc段与cd段所消耗CO2的体积相同
C. bc段反应的离子方程式是2AlO2-+3H2O+CO2 = 2Al(OH)3↓+CO32-
D. de段沉淀减少是由于BaCO3固体的消失
查看答案和解析>>
科目: 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO![]() )=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是![]()
A.![]() 溶于水的电离方程式为
溶于水的电离方程式为![]() ,向
,向![]() 溶液中加入少量
溶液中加入少量![]() 固体,电离平衡正向移动
固体,电离平衡正向移动
B.![]() 在熔融状态下的电离方程式为
在熔融状态下的电离方程式为![]() ,向醋酸中加入少量
,向醋酸中加入少量![]() 固体,电离平衡逆向移动
固体,电离平衡逆向移动
C.向稀氨水中滴加少量![]() ,溶液,
,溶液,![]() 与
与![]() 结合生成
结合生成![]() ,使平衡正向移动,电离常数增大
,使平衡正向移动,电离常数增大
D.常温下,冰醋酸加水稀释的过程中,溶液的导电能力先增大后减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com