
科目: 来源: 题型:
【题目】氯碱厂以食盐等为原料,生产烧碱、盐酸等化工产品。工艺流程可简单表示如图:
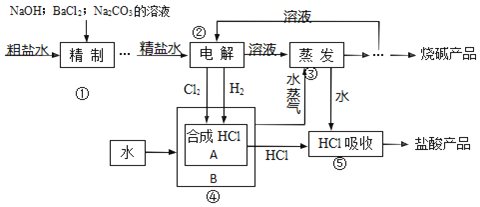
完成下列填空:
(1)粗盐水中含有 MgCl2、CaCl2、Na2SO4 等可溶性杂质,①步骤必须先后加入稍过量的 NaOH、BaCl2、Na2CO3溶液后过滤除杂。试写出加入 Na2CO3溶液时发生反应的离子方程式:______。写出②步骤发生反应的化学方程式:______。
(2)③步骤之后获得干燥的烧碱产品的有关操作有______。进行④步骤的生产设备 A、B之间传递的是(选填编号)______。
A.只有物料
B.既有物料又有能量
C.只有能量
D.既无物料也无能量
(3)如果用下列装置在实验室进行⑤步骤的实验,正确的是(选填编号)______。

若检验烧碱产品中是否含有少量 NaCl 杂质的实验方案是______。
(4)为测定烧碱产品的纯度,准确称取 5.000g 样品(杂质不含碱性物质)置于烧杯中,加水搅拌,冷却至室温后,将溶液全部转移入 1000mL 的容量瓶之后的一步操作是______。从所配得的溶液中每次都取出 20.00mL,用 0.12mol/L的盐酸滴定(选用常用指示剂),两次分别用去盐酸溶液19.81mL 和 19.79mL.判断滴定终点的依据是______,根据实验数据计算此烧碱产品的纯度为(保留两位小数)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的应用前景。工业上采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
(1)下表所列数据是反应I在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.04 | 0.25 | 0.012 |
①由表中数据判断ΔH1 _________0 (填“>”、“=”或“<”)。
②某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,5 min后达到平衡,测得c(CO)=0.2 mol/L,则用H2表示的5min内该反应的反应速率v(H2)=_______mol·L-1·min-1,该温度下此反应的平衡常数为___________,此时的温度为________(从上表中选择)。
(2)一定条件下,将1 mol CO与 3 mol H2的混合气体在催化剂作用下能自发反应生成甲醇。若容器容积不变,下列措施可提高CO转化率的是________。
A.升高温度 B.将CH3OH(g)从体系中分离
C.恒容条件下充入He D.再充入适量的 H2
(3)为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
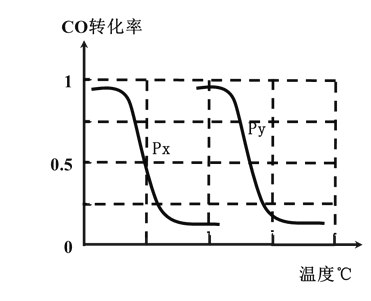
实验编号 | 温度(℃) | n(CO)/n(H2) | 压强(MPa) |
1 | a | 1/2 | 0.2 |
2 | 200 | b | 5 |
3 | 350 | 1/2 | 0.2 |
A.则上表中剩余的实验条件数据:a=________、b=_______。
B.根据反应I的特点,左下图是在压强分别为0.2MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强Py=______MPa。
(4)上述反应中需要用到H2做反应物,以甲烷为原料制取氢气是常用的制氢方法。已知:
①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂生产新型清洁燃料甲醚(CH3-O-CH3)的流水线反应原理为:在 10L 的反应容器内进行的反应①的化学平衡常数表达式为K=[CO][H2]/[H2O]。反应②的热化学方程式为:3H2(g)+3CO(g)CH3OCH3(g)+CO2(g)+Q。反应③为:CO2+NH3+H2O→NH4HCO3,完成下列填空:
(1)反应①的方程式为______。经3min反应容器内的水蒸气从20.0mol变为 2.0mol,则此 3min 内 CO 的平均反应速率V(CO)=______。
(2)能判断反应①已达化学平衡状态的是(选填编号)______。
A.在消耗 n 摩尔氢气的同时产生 n 摩尔的水
B.容器内气体的平均相对分子质量保持不变
C.容器内所有的物质的总物质的量保持不变
D.化学反应速率:V(逆)(H2O)=V(正)(CO)
(3)已知升高温度,反应②的化学平衡常数会减小,则反应②的热化学方程式中的Q(选填“>”或“<”)______0。该反应的逆反应速率V(逆)随时间 t 变化的关系如图一所示,则在 t2时改变的反应条件是______。
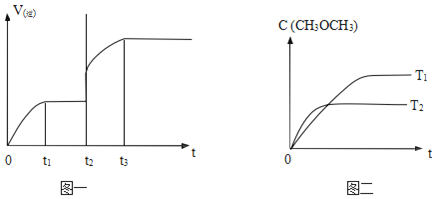
(4)在不同温度下,反应容器内甲醚(CH3OCH3)的浓度c(CH3OCH3)随时间t 变化的状况如图二所示。则反应温度 T1(选填“>”、“=”或“<”)______T2。
(5)若反应③得到的是一种纯净常见化肥的溶液。经测定溶液中也存在 NH3H2O 分子和CO32-离子,试用化学用语表示产生这两种微粒的原因:______,______。相同温度下,都为 0.1mol/L的 NaHCO3溶液甲和 NH4HCO3溶液乙相比较,溶液中c(CO32-)甲(选填“>”、“=”或“<”)甲______乙。
查看答案和解析>>
科目: 来源: 题型:
【题目】K 是称为 PTT 的高分子材料,因具有优良的性能而可作工程塑料、纺织纤维等有广泛的应用。如图所示是 PTT 的一种合成路线。
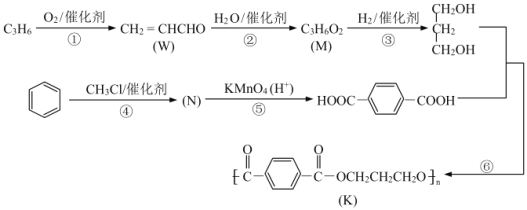
已知: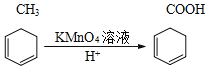
完成下列填空:
(1)W 所含官能团的名称为______。反应③的化学反应类型为______。
(2)M 的结构简式为______,反应④的化学反应方程式为______。
(3)反应⑥的另一无机产物是______,与反应⑥的化学反应类型无关的是(选填编号)______。
A.聚合反应B.酯化反应C.消去反应D.加成反应
(4)有机物X 的分子式为 C4H8O2,是 M 的同系物。则 X 可能的结构简式共有______种。
(5)设计一条由甲苯为原料(无机试剂可任选)合成苯甲酸苯甲酯的合成路线。(合成路线常用表示方式为 A![]() B ……
B ……![]() 目标产物)_____________
目标产物)_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】新型陶瓷材料氮化硅(Si3N4)可用于制作火箭发动机中燃料的喷嘴。氮化硅可由石英、焦炭在高温氮气流中制取。完成下列填空:______SiO2+______C+______N2![]() ______Si3N4+______CO。
______Si3N4+______CO。
(1)试配平该化学反应方程式,将系数填写在对应位置上。在方程式上标出电子转移的方向和数目。____________
(2)反应中______被还原,当氧化产物比还原产物多 1mol 时,反应中电子转移数为______。
(3)在该反应体系中:所涉及物质属于非极性分子的电子式为______;所涉及元素中原子半径最大的原子的最外层电子排布式为______。
(4)反应的主要产物氮化硅所属的晶体类型为______,证明氮化硅组成元素非金属性强弱:
(Ⅰ)写出一个化学事实______;
(Ⅱ)从原子结构上进行说明:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。
②向滤液中通入Cl2,搅拌。
③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。
④把③所得滤液浓缩。
(1)①中加热并搅拌的目的是_____________________________。
(2)②中发生反应的离子方程式是_________________________。
(3)③中的物质A可能是__________________;调整的PH范围是_______________;
过滤后滤渣的成分是__________________。
(4)③中发生反应的离子方程式是_________________________。
(5)①③中如何用pH试纸测定溶液的pH值:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,甲乙两装置的电极材料和电解质溶液均相同,则两装置中相同的是( )
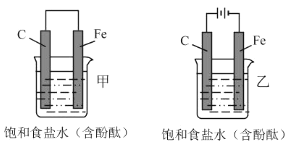
A.在碳电极上所发生的电极反应B.在铁电极附近的溶液先变红色
C.铁极与导线连接处的电流方向D.碳电极既不会变大也不会减小
查看答案和解析>>
科目: 来源: 题型:
【题目】工业制纯碱的化学史上,侯德榜使用而索尔维法没有使用的反应原理的化学方程式是( )
A.CO2+NaCl+NH3+H2O→NaHCO3↓+NH4Cl
B.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.CaO+2NH4Cl→CaCl2+2NH3↑+H2O
D.NaHCO3+NH3+NaCl→Na2CO3+NH4Cl↓
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)依据反应:2Ag+(aq)+Cu(s)![]() Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
①电极X的材料是___________;Y溶液可以是____________;
②银电极上发生的电极反应式是_________________________。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是______(填离子符号)。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。
①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式__________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用___________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的_______极。

(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O![]() Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是____(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的PH_________(填增大、减小、不变)
③充电时该电池阳极的电极反应式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )

A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+![]() Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com