
科目: 来源: 题型:
【题目】常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A.1.7B.2.0C.12.0D.12.4
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.100 mol·L-1盐酸分别滴定20.00 mL 0.100 mol·L-1的氨水和20.00 mL 0.100 mol·L-1NaOH溶液,两溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是 ( )

A. Kb(NH3·H2O)的数量级为10—4
B. 10 < a < 20
C. P点溶液中:c(NH4+)>c(Cl一)
D. 水的电离程度:M > N > P
查看答案和解析>>
科目: 来源: 题型:
【题目】大运会时深圳新能源汽车上有一种质子交换膜燃料电池,工作原理如图所示,下列叙述正确的是( )
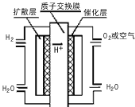
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.总反应式为O2+2H2![]() 2H2O
2H2O
D.正极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】传统接触法制取硫酸能耗大,污染严重。将燃料电池引入 硫酸生产工艺可有效解决能耗和环境污染问题,同时提供电能 以燃料电池为电源电解硫酸铜溶液的工作原理示意图如下所示。下列说法不正确的是( )
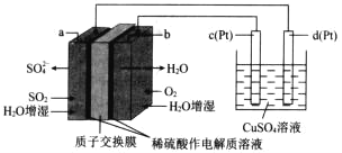
A.若 a 极消耗 2.24LSO2,理论上 c 极有 6.4g 铜析出
B.H+由 a 极通过质子交换膜向 b 极移动
C.该燃料电池的总反应式为 2SO2+O2+2H2O=2H2SO4
D.b 极为正极,电极反应式为 O2+4H++4e-=2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关盐类水解的说法中,不正确的是( )。
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆反应
C. 盐类水解后的溶液不一定显中性
D. ![]() 溶液中,
溶液中, ![]() 是
是![]() 的两倍
的两倍
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、M、N是短周期主族元素,且原子序数依次增大。已知X原子的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大。下列说法正确的是
A.Y2X和Y2X2中化学键类型相同,阴、阳离子的个数比相同
B.气态氢化物的热稳定性:M>N
C.M与X的化合物对应的水化物一定是强酸.
D.离子半径![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,80g SO3 所含的原子数为 4NA
B.过氧化钠与水反应时,生成 0.1molO2 转移的电子数为 0.2NA
C.1mol N2、3mol H2 混合反应,当生成 0.1mol NH3 时,转移电子数目为 0.3NA
D.100mL 0.1molL-1 的 Na2S 溶液,含有的阴离子数目为 0.01NA
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有 Al2O3、CaO 等杂质),钙化法焙烧制备 V2O5,其流程如下:
![]()
(资料)+5 价钒在溶液中的主要存在形式与溶液 pH 的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3- | V2O74- | VO43- |
(1)焙烧: 向石煤中加生石灰焙烧,将 V2O3 转化为 Ca(VO3)2 的化学方程式是______________。
(2)酸浸:①Ca(VO3)2 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 pH=4,Ca(VO3)2 溶于盐酸的离子方程式是________。
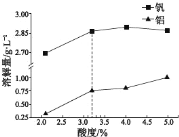
②酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约 3.2%,根据下图推测,酸浸时不选择更高酸度的原因是________________。
(3)转沉: 将浸出液中的钒转化为 NH4VO3 固体,其流程如下:
![]()
①浸出液中加入石灰乳的作用是_____。
②向(NH4)3VO4 溶液中加入 NH4Cl 溶液,控制溶液的 pH=7.5。当 pH>8 时,NH4VO3 的产量明显降低,原因是_______________。
(4)测定产品中 V2O5 的纯度:称取 ag 产品,先用硫酸溶解,得到(VO2)2SO4 溶液。再加入 b1mLc1mol/L(NH4)2Fe(SO4)2 溶液(VO2++2H++Fe2+=VO2++Fe3++H2O) 最后用 c2mol/LKMnO4 溶液滴定过量的(NH4)2Fe(SO4)2 至终点,消耗 KMnO4 溶液的体积为 b2mL。已知 MnO4-被还原为 Mn2+,假设杂质不参与反应。则产品中 V2O5 的质量分数是_____。(V2O5 的摩尔质量::182g/mol)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有氨水和盐酸两溶液。回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ________。(增大、减小、不变)
________。(增大、减小、不变)
(2)若向该氨水中加入氢氧化钠固体,则该电离平衡向_________方向移动(分子化、离子化),电离平衡常数______________。(增大、减小或不变)
(3)0.2 mol/L氨水和0.2 mol/L 盐酸溶液与等体积混合,溶液呈_____性 (酸、碱、中) ;其原因用离子方程式表示为__________________。混合液中,c(NH4+)+c(NH3H2O)=_______mol/L。(忽略体积变化)。请根据电荷守恒写出一个用离子浓度表示的等式_____________________。
(4)用0.1000mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
序号 | 0.100mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
该滴定可以使用的指示剂是__________;达到滴定终点时的现象是____________________。
待测NaOH溶液的物质的量浓度为_____________mol/L。(保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com