
科目: 来源: 题型:
【题目】石油和煤都是重要的能源和化工原料,如图1是煤化工产业链的一部分。

试用所学知识,解决下列问题:
(1)柴油是由石油加工得到的重要产品,它在燃烧时往往冒黑烟,可能的原因是____。
(2)煤经过干馏可以得到焦炉气、煤焦油和焦炭等。煤焦油经过____(填加工方法)可得到芳香族化合物。
(3)煤的直接液化是煤和适当溶剂混合在高温和____存在下与____作用生成液态燃料的过程。
(4)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的化学式为____。
(5)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨--空气混合气体中氧氨比的关系。其中直线表示反应的理论值;曲线表示实际生产情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=___,实际生产将γ维持在1.7~2.2之间,原因是____。

查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )

A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:锂硫电池的总反应为2Li+xS===Li2Sx。以锂硫电池为电源,通过电解含(NH4)2SO4 的废水制备硫酸和化肥的示意图如图 (不考虑其他杂质离子的反应)。下列说法正确的是

A. b为电源的正极
B. 每消耗32 g硫,理论上导线中一定通过2 mol e-
C. SO42-通过阴膜由原料室移向M室
D. N室的电极反应式为2H2O-4e-===O2↑+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
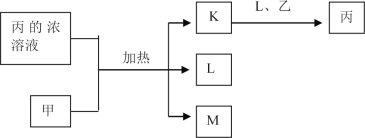
A. 原子半径:W<X<Y B. 元素的非全属性:Z>Y>X
C. 化合物XYZ中只含共价键 D. K、L、M中沸点最高的是M
查看答案和解析>>
科目: 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图

下列叙述正确的是( )
A.迷迭香酸属于芳香烃
B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C.迷迭香酸可以发生水解反应,取代反应和酯化反应
D.1 mol迷迭香酸最多能和含5 mol NaOH的水溶液完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】近年来流行喝苹果醋。苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等作用的保健食品。苹果酸(α羟基丁二酸)是这种饮料的主要酸性物质,其结构如下图所示:

下列相关说法正确的是( )
A. 苹果酸在一定条件下能发生消去反应
B. 苹果酸在一定条件下能催化氧化生成醛
C. 苹果酸在一定条件下能发生加聚反应生成高分子化合物
D. 1 mol苹果酸与NaHCO3溶液反应最多消耗3 mol NaHCO3
查看答案和解析>>
科目: 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,22.4L己烯中含有碳氢键数目为12NA
B.100g质量分数17%H2O2溶液中极性键数目为NA
C.65gZn与一定量的浓硫酸完全反应得混合气体的分子数为NA
D.电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:

⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是_____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是_______。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是__;反应Ⅲ的化学方程式为________________。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是_________________________。
② 滴定过程中,至少须平行测定两次的原因是________________________。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为__________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)如图1表示用相同浓度的NaOH溶液分别滴定浓度相同的3种一元酸,由图可确定酸性最强的是____(填“①”、“②“或“③”)。如图2表示用相同浓度的硝酸银标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是 _____。
图1  图2
图2 
(2)25℃时,Ksp(AgCl)=1.8×10-10,若向1L0.1mol·L-1的NaCl溶液中加入1L0.2mol·L-1的硝酸银溶液,充分反应后溶液中c(Cl-)=________(不考虑混合后溶液体积的变化)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com