
科目: 来源: 题型:
【题目】党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。
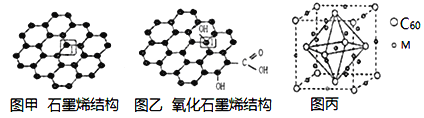
(1)图乙中1号C与相邻C有无形成π键__________(填“有”、或“无”)。
(2)图甲中1号C的杂化方式________。该C与相邻C形成的键角______(填“>”、“<”或“=”)1200。
(3)我国制墨工艺是将50nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是____________________。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为______________,该材料的化学式为_______________。
(5)金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为___________(用含π的代数式表示)。
(6)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
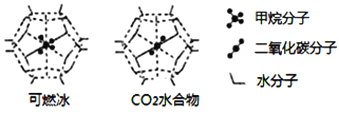
①“可燃冰”中分子间存在的2种作用力是_________;
②有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,结合图表从物质结构及性质的角度分析,该设想能否实现:________ (填“能”、或“否”)。
可燃冰与二氧化碳替换的水合物的熔点较高的是_________。
参数 分子 | 分子直径/nm | 分子与H2O的结合能E/(kJ·mol-1) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
查看答案和解析>>
科目: 来源: 题型:
【题目】数十年来,化学工作者对氮的氧化物、碳的氧化物做了广泛深入的研究并取得一些重要成果。
I.已知2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
第一步:2NO(g) ![]() N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
N2O2(g) (快) H1<0;v1正=k1正c2(NO) ;v1逆=k1逆c(N2O2)
第二步:N2O2(g)+O2(g) ![]() 2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
2NO2(g) (慢) H2< 0; v2正=k2正c(N2O2)c(O2);v2逆=k2逆c2(NO2)
①2NO(g)+O2(g) ![]() 2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
2NO2(g)的反应速率主要是由______(填“第一步”或“第二步”)反应决定。
②一定温度下,反应2NO(g)+O2(g) ![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=____________;
II.利用CO2和CH4重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放(1)已知重整过程中部分反应的热化方程式为:
① CH4(g)=C(s)+2H2(g) ΔH>0
② CO2(g)+H2(g)=CO(g)+H2O(g) ΔH>0
③ CO(g)+H2(g)=C(s)+H2O(g) ΔH<0
固定n(CO2)=n(CH4),改变反应温度,CO2和CH4的平衡转化率见图甲。
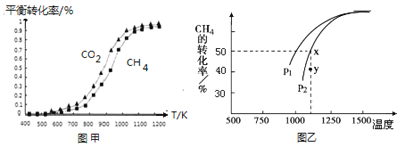
同温度下CO2的平衡转化率________(填“大于”“小于”或“等于”)CH4的平衡转化率。
(2)在密闭容器中通入物质的量均为0.1mol的CH4和CO2,在一定条件下发生反应CO2(g) + CH4(g) ![]() 2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
2CO(g) + 2H2(g),CH4的平衡转化率与温度及压强(单位Pa)的关系如图乙所示。y点:v(正)_____v(逆)(填“大于”“小于”或“等于”)。已知气体分压(p分)=气体总压(p总)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,求x点对应温度下反应的平衡常数Kp=__________________。
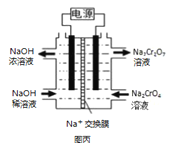
III.根据2CrO42﹣+2H+ ![]() Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
Cr2O72﹣+H2O设计如图丙装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图丙中右侧电极连接电源的__极,电解制备过程的总反应方程式为__。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为a:b,则此时Na2CrO4的转化率为__。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或表示方法正确的是
A.等质量的硫蒸气和硫粉分别完全燃烧,后者放出的热量多
B.化学反应A2(g)+2B2(g)===2AB2(g)能量变化如图所示,该反应为放热反应
C.在25℃、101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)![]() 2H2O(l)△H= -285.8kJ·mol-1
2H2O(l)△H= -285.8kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)![]() H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
H2O(l)△H=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,整个过程放出的热量大于57.3kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结 论 |
A | 向一定浓度的Na2SiO3 溶液中通入适量CO2 气体, 出现白色沉淀。 | H2SiO3 的酸性比H2CO3的酸性强 |
B | 将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色 | Fe(NO3)2已变质 |
C | 室温下,测得:0.1mol·L-1 Na2SO3溶液的pH约为10;0.1mol·L-1 NaHSO3溶液的pH约为5。 | HSO3- 结合H+ 的能力比SO32-的强 |
D | 分别向25mL冷水和25mL沸水中滴入6滴FeCl3 饱和溶液,前者为黄色,后者为红褐色。 | 温度升高,Fe3+的水解程度增大 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下面提到的问题中,与盐的水解有关的是
①明矾可作净水剂
②为保存FeCl3溶液,要在溶液中加少量盐酸
③NH4Cl溶液可作焊接中的除锈剂
④实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞而不能用玻璃塞
A.①④B.②③C.③④D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列各溶液中,一定能大量共存的离子组是
A.常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3-
B.滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3-
C.使石蕊呈红色的溶液:NH4+、NO3﹣、AlO2﹣、I﹣
D.常温下![]() =1014的溶液中:K+、Ba2+、Cl-、Br-
=1014的溶液中:K+、Ba2+、Cl-、Br-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
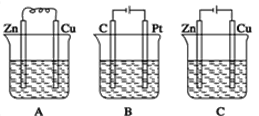
(1)A、B、C三个装置中属于原电池的是___(填标号)。
(2)A池中Zn是___极,电极反应式为___;A中总反应的离子方程式___。
(3)B池中总反应的方程式为___。
(4)C池中Zn是___极,发生___反应,电极反应式为___;反应过程中,CuCl2溶液浓度___(填“变大”“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,H2A和H2NCH2CH2NH2溶液中各组分的物质的量分数δ随pH的变化如图(I)、(II)所示。下列说法不正确的是已知:![]() 。
。
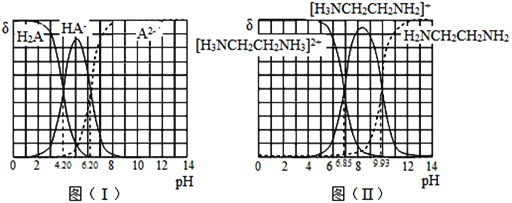
A.NaHA溶液中各离子浓度大小关系为:![]()
B.乙二胺(H2NCH2CH2NH2)的Kb2=10-7.15
C.[H3NCH2CH2NH3]A溶液显碱性
D.向[H3NCH2CH2NH2] HA溶液中通人HCl,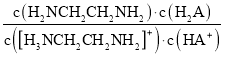 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】分别取1 molA、B、C、D、E、F六种有机物,使它们充分燃烧,都生成44.8LCO2(标况),D和E是碳、氢、氧的化合物,两者互为同分异构体,E被氧化成A,A继续氧化成B,C、F都能发生加聚反应,C和氯化氢加成生成F。试推断有机化合物A、B、C、D、E、F的结构简式。
(1)A.______、B.______、C.______、D.______、E.______、F.______。
(2)写出下列反应的化学方程式
E→A:_________________________________________。
实验室制备C:__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
| 30% H2O2 | 15% H2O2 | 10% H2O2 | 5% H2O2 |
无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
无催化剂、加热 | 360 | 480 | 540 | 720 |
MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
①该研究小组在设计方案时。考虑了浓度、___________、____________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?_______________________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%(密度为1.0g/cm3)的双氧水中,并用带火星的木条测试。测定结果如下:
实验 序号 | 催化剂(MnO2) | 操作 情况 | 观察结果 | 反应完成 所需的时间 |
A | 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 5span>分钟 |
B | 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生分解的化学反应方程式________________。求出实验A中H2O2在5分钟内的平均反应速率________________。(结果保留小数点后两位数字)
② 实验结果说明催化剂作用的大小与____________________有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com