
科目: 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目: 来源: 题型:
【题目】(化学——选修3:物质结构与性质)
钴及其化合物在生产中有重要作用,回答下列问题
(1)钴元素基态原子的电子排布式为________________,未成对电子数为________________。
(2)配合物[Co(NH3)4(H2O)2]Cl3是钴重要化合物
①H2O的沸点___ (填“高于”或“低于”)H2S,原因是_______;H2O中O的杂化形式为_____。H2O是_____分子(填“极性”或“非极性”)。
②[Co(NH3)4(H2O)2]Cl3中的Co3+配位数为___。阳离子的立体构型是___________。[Co(NH3)4(H2O)2]Cl3若其中有两个NH3分子被Cl取代,所形成的[Co(NH3)2Cl2(H2O)2]3+的几何异构体种数有(不考虑光学异构)___________种。
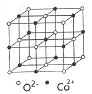
(3)一氧化钴的晶胞如图,则在每个Co2+的周围与它最接近的且距离相等的Co2+共有_____个,若晶体中Co2+与O2-的最小距离为acm,则CoO的晶体密度为_______(用含NA和a的代数式表示。结果g/cm3,已知:M(Co)=59g/mol;M(O)=16g/mol,设阿伏加德罗常数为NA)。
查看答案和解析>>
科目: 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
nCH3CH=CH2![]()
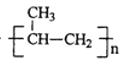
TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
(1)Ti3+的基态核外电子排布式为__________。
(2)丙烯分子中,碳原子轨道杂化类型为______和____。
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________。
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________。
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______。
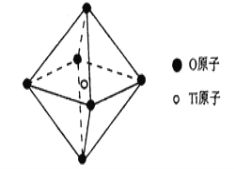
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.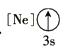 B.
B.![]() C.
C.![]() D.
D.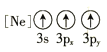
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与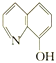 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
(1)基态As原子的价电子排布图为____________,基态Ga原子核外有________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJmol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____和+3,砷的电负性比镓____(填“大”或“小”)。
(3)1918年美国人通过反应:HC≡CH+AsCl3![]() CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
CHCl=CHAsCl2制造出路易斯毒气。在HC≡CH分子中σ键与π键数目之比为________;AsCl3分子的空间构型为___________。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中碳原子的杂化方式为_______
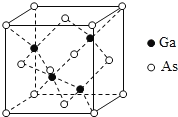
(5)GaAs为原子晶体,密度为ρgcm-3,其晶胞结构如图所示, Ga与As以_______键键合。Ga和As的原子半径分别为a pm和b pm,设阿伏伽德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为_______________(列出计算式,可不化简)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一瓶久置的Na2SO3(杂质只有Na2SO4),为了测定其纯度,取样品5.0 g配成100 mL溶液,取其中25.00 mL于锥形瓶中,用0.10 molL-1酸性KMnO4溶液进行滴定,到终点时消耗KMnO4溶液20.00 mL,求此样品的纯度。_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
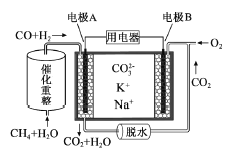
A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某温度下,无水Na2CO3的溶解度是10.0 g/(100 g水)。在该温度下,向足量的饱和Na2CO3(aq)中加入1.06 g无水Na2CO3,搅拌后静置。试求最终所得晶体的质量_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:
①准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;
② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;
③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.5825g。
次硫酸氢钠甲醛和碘反应的方程式如下:xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com