
科目: 来源: 题型:
【题目】下列实验操作或对实验事实的叙述中存在错误的是 ( )
A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.酸碱中和滴定时,锥形瓶未用待装液润洗。
D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关仪器使用方法或实验操作正确的是![]()
A.洗净的锥形瓶和容量瓶可以放进烘箱烘干
B.酸式滴定管装标准溶液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待滴定溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余液体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是元素周期表的一部分:
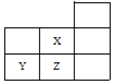
数据编号 | 滴入NaOH溶液的体积 | 溶液的pH | |
HX | HZ | ||
1 | 0 | 3 | 1 |
2 |
| a | b |
![]() 时,用浓度为
时,用浓度为![]() 的氢氧化钠溶液分别滴定
的氢氧化钠溶液分别滴定![]() 浓度均为
浓度均为![]() 的两种酸HX、
的两种酸HX、![]() 忽略体积变化
忽略体积变化![]() ,实验数据如表2,下列判断正确的是
,实验数据如表2,下列判断正确的是![]()
A.通过分析可得表格中![]() ,
,![]()
B.将上述的HZ溶液稀释100倍后pH比HX溶液的pH大
C.由于Z元素的非金属性比Y强,所以Z氢化物的酸性较强
D.![]()
![]()
![]() 的水溶液中:
的水溶液中:![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,结构简式为 ,由(CH3)2C=CH2为原料合成G的路线如下:
,由(CH3)2C=CH2为原料合成G的路线如下:

其中A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:(i). 
(ii).物质D的分子式为C8H14O4,能发生银镜反应
(iii).第⑤步反应条件为:H2O/H+,E的结构简式为: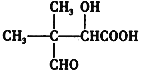
请回答下列问题:
(1)G物质中含有的官能团的名称为________,物质A的名称为________。(用系统命名法命名)
(2)第②步反应的反应类型为____________,物质D的结构简式为________。
(3)写出第③步反应的化学方程式____________________。
(4)同时满足下列条件的E的同分异构体共有____________种,其中核磁共振氢谱只有3组峰,且面积之比为3:1:1的结构简式为____________。
①只含有一种官能团;②链状结构且无-O-O-;③能与NaHCO3反应放出气体
(5)已知: 是一种重要的药物中间体,结合上述信息,请以
是一种重要的药物中间体,结合上述信息,请以![]() 和HCHO为原料设计它的合成路线(无机试剂任选),写出其合成路线__________。
和HCHO为原料设计它的合成路线(无机试剂任选),写出其合成路线__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡等,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(室温) | Ka= 1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①0.1mol/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3- )(填“>”、“<”或“=”)。
②将浓度均为0.1mol/L的CH3COONa、NaCN、NaHCO3和Na2CO3溶液分别稀释100倍,pH变化最小的是__________。
③将少量CO2通入NaCN溶液,反应的离子方程式是_____。
④室温下,—定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_____,溶液中c(CH3COO-)/c(CH3COOH) =___________。
⑤室温下,某溶液中存在着CH3COOH(aq)+HCO3-( aq)CH3COO-(aq) +H2CO3(aq),该反应的平衡常数K =___________。
⑥室温下,pH =4的CH3COOH与pH =10的CH3COONa溶液中,由水电离出的c(H+)之比_______。
(2)已知室温下Cu(OH)2的Ksp=2×10-20,又知室温下某CuSO4溶液中c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于___________
查看答案和解析>>
科目: 来源: 题型:
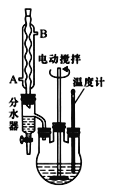
【题目】苯甲酸乙酯可由苯甲酸与乙醇在浓硫酸共热下反应制得(已知苯甲酸的酸性强于碳酸),反应装置如图(部分装置省略),反应原理如下:
 +C2H5OH
+C2H5OH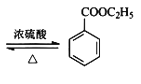 +H2O
+H2O
实验操作步骤:
①向三颈烧瓶内加入12.2 g苯甲酸、25 mL乙醇、20 mL苯及4 mL浓硫酸,摇匀,加入沸石。
②装上分水器、电动搅拌器和温度计,加热至分水器下层液体接近支管时将下层液体放入量筒中。继续蒸馏,蒸出过量的乙醇,至瓶内有白烟(约3h),停止加热。
③将反应液倒入盛有80 mL冷水的烧杯中,在搅拌下分批加入碳酸钠粉末至溶液无二氧化碳逸出,用pH试纸检验至呈中性。
④用分液漏斗分出有机层,水层用25 mL乙醚萃取,然后合并至有机层。用无水CaC12干燥,粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收210—213℃的馏分,最终通过蒸馏得到纯净苯甲酸乙酯12.8 mL。
可能用到的有关数据如下:
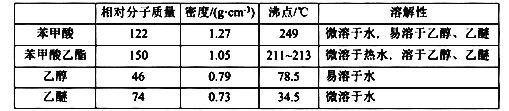
回答以下问题:
(1)反应装置中分水器上方的仪器名称是______
(2)步骤①中加浓硫酸的作用是________,加沸石的目的是______。
(3)步骤②中使用分水器除水的目的是__________。
(4)步骤③中加入碳酸钠的目的是____________ 。
(5)步骤④中有机层从分液漏斗的____(选填“上口倒出”或“下口放出”)。
(6)蒸馏操作中温度计水银球的位置应为下图中________(填a、b、c、d)所示。
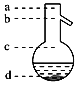
(7)本实验所得到的苯甲酸乙酯产率______%。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.0kJ/mol;
CH3OH(g) △H1=-90.0kJ/mol;
3CH3OH(g) ![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol
CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)甲醇(CH3OH)可作为新型汽车动力燃料,工业上可由CO与 H2在催化剂作用下合成甲醇。现向体积为2L的恒容绝热密闭容器中,充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.0kJ/mol。当反应进行到5min时达到平衡状态,此时CH3OH的物质的量为0.6mol,则
CH3OH(g) △H1=-90.0kJ/mol。当反应进行到5min时达到平衡状态,此时CH3OH的物质的量为0.6mol,则
①5 min内反应的平均速率ν(H2) = _____ mol/(L·min)。
②达到平衡时放出的热量为________ kJ
③不能说明该反应已达到平衡状态的是____(选填字母标号)
a.CO的物质的量不再改变 b.容器内温度保持不变
c.CH3OH的消耗速率与生成速率相等 d.容器内的密度保持不变
(3)一种甲醇燃料电池如图,使用的电解质溶液是2mol·L-1的KOH溶液。
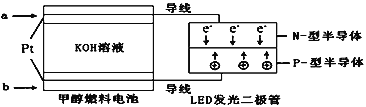
请写出加入(通入)a物质一极的电极反应式_____;每消耗9.6g甲醇转移的电子数为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是 ( )
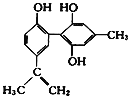
A.该分子中的所有碳原子可能共平面
B.该物质在一定条件下能发生加聚反应
C.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
D.1 mol该物质与足量浓溴水反应时最多消耗Br2为4 mol
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将CO2通入2L pH=12的KOH溶液中,溶液中水电离出的OHˉ离子浓度(c)与通入的CO2的体积(V)的关系如图所示.下列叙述不正确的是 ( )
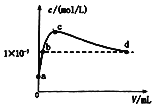
A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(K+)>c(CO32 -)>c(HCO3- )
C.c点溶液中: c(K+)=c(HCO3- )+c(CO32 -)+c(H2CO3)
D.d点溶液中: c(H+)=1×10-7mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com