
科目: 来源: 题型:
【题目】硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
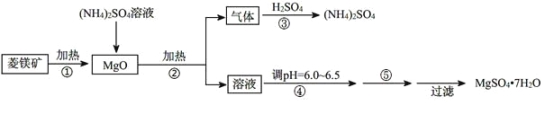
(1)步骤②中发生反应的离子方程式为____________________________________。
(2)步骤④中调节pH=6.0~6.5的目的是___________________________________。
(3)步骤⑤的操作为______________________________
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_____[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
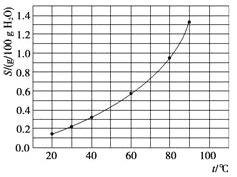
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
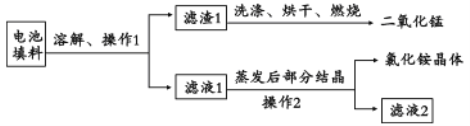
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:

用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。
主反应:C4H10(g,正丁烷)![]() C2H4(g)+C2H6(g) ΔH1
C2H4(g)+C2H6(g) ΔH1
副反应:C4H10(g,正丁烷)![]() CH4(g)+C3H6(g) ΔH2 回答下列问题:
CH4(g)+C3H6(g) ΔH2 回答下列问题:
(1)化学上,将稳定单质的能量定为0,生成稳定化合物时的释放或吸收能量叫生成热,生成热可表示该物质相对能量。下表为25℃、101 kPa下几种有机物的生成热:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ·mol1 | 75 | 85 | 52 | 20 | 125 | 132 |
①表格中的物质,最稳定的是________________(填结构简式)。
②上述反应中,ΔH1=____________kJ·mol1。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。下列情况表明该反应达到平衡状态的是_________________(填代号)。
A.气体密度保持不变 B.![]() 保持不变
保持不变
C.反应热不变 D.正丁烷分解速率和乙烷消耗速率相等
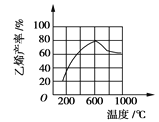
(3)向密闭容器中充入丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,
随着温度升高,乙烯产率降低,可能的原因是____________(填代号)。
A.平衡常数降低 B.活化能降低
C.催化剂活性降低 D.副产物增多
(4)在一定温度下向1 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min 达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)为___________mol·L1·min1。
②上述条件下,正丁烷的平衡转化率为_____________;该反应的平衡常数K为____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e=6CO32-,负极反应式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.用标准NaOH溶液滴定充满HCl的烧瓶(标况下,烧瓶容积为V L)做完喷泉实验后得到的稀盐酸(水充满整个烧瓶)以测定它的准确浓度,用酚酞作指示剂。请你回答下列问题:
(1)计算该盐酸的物质的量浓度为:_____。(保留三位有效数字)
(2)现有三种浓度的标准NaOH溶液,你认为最合适的是下列第_____种。
①5.00molL﹣1②0.500molL﹣1③0.0500molL﹣1
(3)若采用上述最合适浓度的标准NaOH溶液滴定,滴定时实验数据列表如下:
实验次数编号 | 待测盐酸体积(mL) | 滴入NaOH溶液体积(mL) |
1 | 10.00 | 8.48 |
2 | 10.00 | 8.52 |
3 | 10.00 | 8.00 |
求这种待测稀盐酸的物质的量浓度c(HCl)=_____。与理论计算值比较,造成的误差的原因可能是哪些下列操作导致的_____
①滴定前平视,滴定终了俯视
②滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定终了无气泡
③滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗
④看到颜色变化后立即读数 ⑤洗涤锥形瓶时,误把稀食盐水当做蒸馏水进行洗涤
II.测定绿矾FeSO4·xH2O中结晶水含量
Ⅰ.准确称量27.8 g绿矾样品,配成250 mL溶液;
Ⅱ.量取25.00 mL所配制的溶液于锥形瓶中;
Ⅲ.用硫酸酸化的0.100 0 mol·L1 KMnO4溶液滴定至终点;
Ⅳ.重复操作3次,消耗KMnO4溶液的体积分别为20.02 mL、24.98 mL、19.98 mL。
(1)判断达到滴定终点时的实验现象是_____。
(2)根据实验记录,计算绿矾化学式中结晶水数目x=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
编号 | 浓度/(mol·L-1) | 浓度/(mol·L-1) | 液的 pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.12 | 0.1 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=11 |
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?___________
(2)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:____________________
(3)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式表示):c(Na+)-c(A-)=______mol·L-1。
(4)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:H2B=H++HB- HB-![]() H++B2-
H++B2-
在0.1 mol·L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1 B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(H+)=c(OH-)+c(HB-)
查看答案和解析>>
科目: 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用离子方程式表示泡沫灭火器的灭火原理:______________
(2)25℃时,Ksp[Fe(OH)3]=2.79×10﹣39,该温度下反应Fe(OH)3+ 3H+ ![]() Fe3++ 3H2O的平衡常数K=_______
Fe3++ 3H2O的平衡常数K=_______
(3)在加热条件下 CeCl3 易发生水解,无水 CeCl3 可用加热 CeCl3·6H2O 和 NH4Cl 固体混合物的方法来制备。其中NH4Cl 的作用是____________
查看答案和解析>>
科目: 来源: 题型:
【题目】H2S为二元弱酸。20℃时,向 0.100 mol·L-1的Na2S溶液中缓慢通入HCl气体(忽略溶液体积的变化及H2S的挥发)。下列指定溶液中微粒的物质的量浓度关系一定正确的是
A.pH=7的溶液中:c(Cl-)=c(HS-)+2c(H2S)
B.通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+)
C.c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol·L-1+c(H2S)
D.c(Cl-)=0.100 mol·L-1的溶液中:c(OH-)-c(H+)=c(H2S)-2c(S2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应 aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的40%,则 ( )
A.物质B的质量分数减小了B.平衡向逆反应方向移动了
C.平衡向正反应方向移动了D.a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com