
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知![]() 的
的![]() ,则所有含有固体MgCO3的溶液中,都有
,则所有含有固体MgCO3的溶液中,都有![]() ,且
,且![]()
C.可通过比较![]() 和
和![]() 的Ksp的大小比较它们的溶解性
的Ksp的大小比较它们的溶解性
D.25 ℃时![]() ,故新生成的 AgCl可转化为AgI
,故新生成的 AgCl可转化为AgI
查看答案和解析>>
科目: 来源: 题型:
【题目】取浓度均为0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。将浓度均为0.1mol/L、体积均为1L的HA溶液和HB溶液分别加水稀释至体积为VL,溶液pH的变化曲线如图所示,则下列说法正确的是

A.HA是强酸,HB是弱酸
B.X是HB,Y是HA
C.常温下,pH相等的NaA溶液与NaB溶液的物质的量浓度:c(NaA)<c(NaB)
D.NaA与NaB的混合溶液中:c(Na+)+c(H+)=c(A-)+c(B-)+c(HA)+c(HB)
查看答案和解析>>
科目: 来源: 题型:
【题目】钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将![]() 和
和![]() 转化成难溶弱酸盐。
转化成难溶弱酸盐。
已知:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)将SrSO4转化成SrCO3的离子方程式为:_______________________________________,该反应的平衡常数表达式为_____________________________________;该反应能发生的原因是:________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”“减小”或“不变”):
①升高温度,平衡常数K将__________________________________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrSO4。实验所用的试剂为________;实验现象及其相应结论为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:aA(g)+ bB(g)![]() cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答:
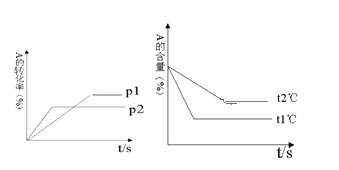
(1)压强p1 _________p2(填“>”或“<”);
(2)a +b__________c +d(填“>”或“<”);
(3)温度t1℃_________t2℃(填“>”或“<”);
(4)正反应为_________反应。(填吸热或放热)
查看答案和解析>>
科目: 来源: 题型:
【题目】对于甲、乙、丙、丁、戊五种溶液有如下信息:
①分别NH4+、Na+、Al3+、Ba2+、Ag+和NO3-、Cl-、SO42-、Br-、CO32-离子中的各一种组成(不重复)。
②其中甲、丙、戊三种溶液呈酸性,乙溶液呈碱性。
③甲、乙反应生成白色沉淀和气体,丁可分别与甲、乙、丙反应生成白色沉淀。
请回答下列问题:
⑴用化学式表示出各物质:乙___________、丁_____________。
⑵请用离子方程式表示戊溶液呈酸性的原因:________________________________。
⑶请用离子方程式表示甲与乙的反应:______________________________________。
⑷检验甲溶液中甲的阴离子的方法是先加_______________试剂,再加_________试剂,观察到
________________现象,证明该阴离子存在。
⑸若丙、丁形成的白色沉淀的溶度积常数Ksp=1.8×10-20,则将1 L 1mol/L的丙溶液与1 L 1 mol/L的丁溶液混合充分反应后,不考虑溶液混合时的微小体积变化,形成沉淀的阳离子的浓度约为_______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
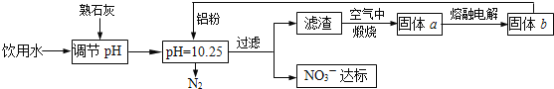
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:
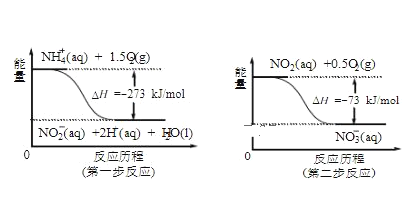
试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答:
①铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。
②写出铁锅腐蚀正极的电极反应式:________________________________
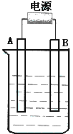
(2)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题:
①A接的是电源的_______极, B电极上的反应式_____________________。
②写出电解时反应的总离子方程式_____________________________________
③电解后溶液的pH为_____________ (假设电解前后溶液的体积不变);
要使电解后溶液恢复到电解前的状态,则需加入__________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的是
A. 向CuSO4溶液中加入足量Zn粉,溶液蓝色消失Zn+CuSO4![]() Cu+ZnSO4
Cu+ZnSO4
B. 澄清的石灰水久置后出现白色固体Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
C. Na2O2在空气中放置后由淡黄色变为白色2Na2O2![]() 2Na2O+O2↑
2Na2O+O2↑
D. 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀3Mg(OH)2+2FeCl3![]() 2Fe(OH)3+3MgCl2
2Fe(OH)3+3MgCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。请回答下列问题:

(1)A点表示Ag2SO4是________(填“饱和”或“不饱和”)溶液。
(2)B点对应的Ksp________(填“>”“<”或“=”)C点对应的Ksp。
(3)现将足量的Ag2SO4分别放入:
A.![]() 溶液
溶液
B.![]() 蒸馏水
蒸馏水
C.![]() 溶液
溶液
则Ag2SO4的溶解程度由大到小的排列顺序为________(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中同时存在![]() 和
和![]() 四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
四种金属离子(浓度均为0.1mol/L)。现用碱调节溶液pH,根据下表可知,下列说法错误的是( )
物质 | 溶度积( |
|
|
|
|
|
|
|
|
A.Al3+最先转化为Al(OH)3沉淀
B.加碱过程中,![]() 几乎同时转化为沉淀
几乎同时转化为沉淀
C.要使Mg2+转化为沉淀,溶液pH应大于9
D.![]() 时,四种金属离子全部以沉淀形式存在
时,四种金属离子全部以沉淀形式存在
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com