
科目: 来源: 题型:
【题目】每天早上5:30起床学习化学会使人变得更加可爱聪明美丽帅气,而丑陋的人则会被尿憋醒,尿的主要成分是尿素,化学式为CO(NH2)2,结构可表示为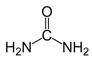 下列有关说法正确的是
下列有关说法正确的是
A.1mol CO(NH2)2分子中含有3mol δ键
B. CO(NH2)2分子中C原子、N原子的轨道杂化类型是均为sp3
C.组成尿素的四种元素第一电离能由大到小的顺序是O、N、C、H
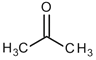
D.根据结构推测,尿素可能易溶于水,熔沸点高于丙酮![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关立方烷分子式:C8H8,结构简式![]() ,下列说法不正确的是
,下列说法不正确的是
A.它的一氯代物只有一种同分异构体,其二氯代物有两种同分异构体
B.分子中存在极性键、非极性键,是一种非极性分子
C.它不是芳香烃,但与苯乙烯互为同分异构体
D.它含碳质量分数与乙炔、苯等物质相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 酸性:H3PO4>HClO,因为 H3PO4 的非羟基氧原子数比 HClO 的多
C. 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致
D. 青蒿素分子式为 C15H22O5,结构见图,该分子中包含 7 个手性碳原子

查看答案和解析>>
科目: 来源: 题型:
【题目】2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品。
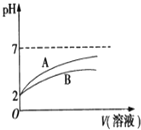
(1)NaCN溶液中各离子浓度大小关系为 ______ 。已知NaCN遇酸能产生HCN;![]() 时,HCN的电离常数
时,HCN的电离常数![]()
![]() ;
;![]() 的电离常数
的电离常数![]()
![]() 。体积均为100mL、
。体积均为100mL、![]() 的
的![]() 溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示
溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示![]() 溶的pH变化趋势的曲线是 ______
溶的pH变化趋势的曲线是 ______ ![]() 选填“A”或“B”
选填“A”或“B”![]() ;相同条件下,NaCN溶液的pH ______
;相同条件下,NaCN溶液的pH ______ ![]() 选填“
选填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 溶液的pH。
溶液的pH。
(2)200℃固体硝酸铵可以分解为![]() 和
和![]() ,此过程中每转移电子8mol放出热量
,此过程中每转移电子8mol放出热量![]() ,写出此反应的热化学方程式 ______ 。
,写出此反应的热化学方程式 ______ 。
(3)工业上用氯气和二氧化钛制备![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ;
;![]() 。此温度下,该反应的平衡常数为400,在密闭容器中加入
。此温度下,该反应的平衡常数为400,在密闭容器中加入![]() 和
和![]() ,反应到t时刻测得各组分的浓度如表所示:
,反应到t时刻测得各组分的浓度如表所示:
物质 |
|
|
|
浓度 |
|
|
|
①根据表中数据判断t时刻此反应向 ______ 反应方向进行![]() 选填“正”或“逆”
选填“正”或“逆”![]() 。
。
②若经10min反应达到平衡,则该时间内反应速率![]() ______。
______。![]() ;下列措施中,可以使平衡向右移动的是 ______
;下列措施中,可以使平衡向右移动的是 ______ ![]() 选填序号
选填序号![]() 。
。
a.使用催化剂 b.增大压强 c.减小压强 d.升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用。请回答下列问题:

Ⅰ:(1)工业生产尿素的原理是以![]() 和
和![]() 为原料合成尿素
为原料合成尿素![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() 。
。
①已知该反应的平衡常数![]() ,则该反应的
,则该反应的![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
②一定温度和压强下,若原料气中的![]() 和
和![]() 的物质的量之比
的物质的量之比![]() 氨碳比
氨碳比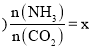 ,图1是氨碳比
,图1是氨碳比![]() 与
与![]() 平衡转化率
平衡转化率![]() 的关系,
的关系,![]() 随着x增大的原因是______;B点处,
随着x增大的原因是______;B点处,![]() 的体积分数为______
的体积分数为______![]() 保留小数点后一位
保留小数点后一位![]() 。
。
③取一定量的![]() 和
和![]() 放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,
放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,![]() 的质量______
的质量______![]() 填“增加”、“减小”或“不变”
填“增加”、“减小”或“不变”![]() 。
。
Ⅱ:(1)某温度下,纯水中![]() ,该温度下,
,该温度下,![]() NaOH溶液与
NaOH溶液与![]() HCl溶液等体积混合
HCl溶液等体积混合![]() 不考虑溶液体积变化
不考虑溶液体积变化![]() 后,溶液的
后,溶液的![]() ______。
______。
(2)向100mL![]()
![]() 的溶液中加入
的溶液中加入![]()
![]() 固体,溶液pH增大,主要原因是
固体,溶液pH增大,主要原因是![]() 请用学过的平衡理论解释
请用学过的平衡理论解释![]() ______;已知该混合溶液中
______;已知该混合溶液中![]() ,则
,则![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
Ⅲ:(1)图2为某温度下,![]() 、
、![]() 、
、![]() 分别在溶液中达到沉淀溶解平衡后,溶液的
分别在溶液中达到沉淀溶解平衡后,溶液的![]() 浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______
浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是______![]() 填化学式
填化学式![]() 。
。
(2)向新生成的ZnS浊液中滴入足量含相同浓度的![]() 、
、![]() 的溶液,振荡后,ZnS沉淀最终会转化为______
的溶液,振荡后,ZnS沉淀最终会转化为______![]() 填化学式
填化学式![]() 沉淀。
沉淀。
查看答案和解析>>
科目: 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是_________(填元素符号,下同)。
(2)黄血盐是由A、B、C、D四种元素形成的配合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂)。请写出黄血盐的化学式_________,黄血盐晶体中各种微粒间的作用力不涉及______________(填序号)。
a.金属键 b.共价键 c.配位键
d.离子键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为___________________,很多不饱和有机物在E催化下可与H2发生加成:如①CH2=CH2 ②HC≡CH ③![]() ④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为______________,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是____________。
④HCHO。其中碳原子采取sp2杂化的分子有____________(填物质序号),HCHO分子的立体结构为______________,它加成后产物甲醇的熔、沸点比CH4的熔、沸点高,其主要原因是____________。
(4)金属C、F晶体的晶胞如下图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为_________。金属F的晶胞中,若设其原子半径为r,晶胞的边长为a,根据硬球接触模型,则r = _______a,列式表示F原子在晶胞中的空间占有率______________(不要求计算结果)。
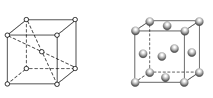
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠被用作肉制品发色剂、防腐剂等,硝酸钠在肉制品加工中作发色剂。但亚硝酸钠是食品添加剂中急性毒性较强的物质之一,是一种剧毒药,摄取少量亚硝酸盐进入血液后,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。硝酸钠的毒性作用主要是由于它在食物中、在水中或在胃肠道内被还原成亚硝酸盐所致。亚硝酸钠生产方法是由硝酸生产过程中的氮氧化物气体![]() 、
、![]() 用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
用氢氧化钠或碳酸钠溶液吸收制得。硝酸钠的生产方法是将硝酸生产中的尾气用碱液吸收后,经硝酸转化,再用碱中和、蒸发、结晶、分离制得。
![]() 实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到
实验室可用加热亚硝酸钠与氯化铵的浓溶液制取氮气,写出该反应的化学方程式:______ ;将亚硝酸钠溶液滴加到含淀粉的酸性KI溶液中,可观察到溶液变蓝色,写出该反应的离子方程式:______ ;将亚硝酸钠溶液滴加到![]() 酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
酸性溶液中,可观察到溶液的颜色由 ______ 色变为绿色,写出该反应的离子方程式:______ 。
![]() 写出氮氧化物
写出氮氧化物![]() 、
、![]() 与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用
与氢氧化钠溶液反应生成亚硝酸钠溶液的离子方程式:______ ;若用![]() 溶液吸收
溶液吸收![]() 可生成
可生成![]() ,
,![]() 和
和![]() 溶液完全反应时转移电子
溶液完全反应时转移电子![]() ,则反应的离子方程式为 ______ 。
,则反应的离子方程式为 ______ 。
![]() 从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
从下列试剂中选用部分试剂鉴别亚硝酸钠、硝酸钠和氯化钠三种无色溶液,它们是 ______ 。
A.稀盐酸![]() 溶液
溶液![]() 稀硝酸
稀硝酸![]() 氢氧化钠溶液
氢氧化钠溶液
![]() 等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______
等物质的量浓度的亚硝酸钠、氯化钠、碳酸钠三种溶液中阴离子总浓度由大到小的顺序是 ______ ![]() 填溶液中溶质的化学式
填溶液中溶质的化学式![]() 。
。
![]() 工业品硝酸钠含少量杂质
工业品硝酸钠含少量杂质![]() 、
、![]() 、NaCl、水不溶物
、NaCl、水不溶物![]() ,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
,某同学欲测定工业品硝酸钠的纯度,进行了如下实验:
![]() 称取
称取![]() 干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL
干燥工业品硝酸钠,投入盛适量蒸馏水的烧杯中,充分搅拌后加入10mL![]() 的A溶液
的A溶液![]() 足量
足量![]() ,充分反应后过滤;
,充分反应后过滤;
![]() 向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
向滤液中加入足量KI溶液和适量稀硫酸,充分反应后将所得溶液配成1000mL溶液;
![]() 取
取![]() 所配溶液于锥形瓶中,加入少量B物质,再用
所配溶液于锥形瓶中,加入少量B物质,再用![]() 的
的![]() 溶液滴定,用去
溶液滴定,用去![]() 溶液
溶液![]() 。
。
(有关反应为:![]()
![]() 溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
溶液中的溶质的化学式是 ______ ,加入A溶液的作用是 ______ 。
![]() 物质是 ______ ,滴定终点时的颜色变化是 ______ 。
物质是 ______ ,滴定终点时的颜色变化是 ______ 。
![]() 若该同学操作正确,但结果造成测定结果略偏高,其原因可能是
若该同学操作正确,但结果造成测定结果略偏高,其原因可能是![]() 任写一点
任写一点![]() ______ 。
______ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。
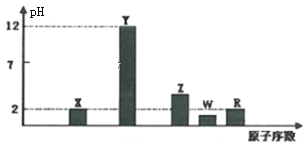
(1)元素R在周期表中的位置是_______;元素Z的原子结构示意图是________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________。
②它们+4价氢氧化物的碱性由强到弱顺序为____________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )

A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目: 来源: 题型:
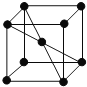
【题目】已知A为周期表中原子半径最小的元素,B、C、D均为第二周期元素,其中B、C、D的电负性:![]() ,第一电离能:
,第一电离能:![]() ,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
,且C无空轨道;E与A同主族,与F、G同周期,F为短周期金属元素,其单质既可以与酸又可以与碱反应放出氢气。G的电子最外层中没有空轨道,且成对电子所占有的轨道数是未成对电子所占轨道数的3倍。
(1)![]() 分子中的中心原子是 ______;
分子中的中心原子是 ______;![]() 离子中B原子的杂化方式为 ______。
离子中B原子的杂化方式为 ______。
(2)![]() 的电子式是 ______,它与
的电子式是 ______,它与![]() 按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
按物质的量之比为1:1混合后投入水中,所发生反应的化学方程式为 ______ 。
(3)![]() 溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
溶液中,阴阳离子浓度由小到大的关系式是 ______ ,若用F单质为电极材料,电解此溶液时,则阳极的发生的电极反应式为 ______。
(4)一定量的![]() 、
、![]() 、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
、CD混合气体投入水中恰好被完全吸收,则混合气体中C、D原子的个数比为 ______ 。
(5)E单质的晶胞如图,其堆积模型是 ______ ,配位数是 ______。
(6)工业上冶炼F的单质时,常用![]() 为原料而不用
为原料而不用![]() 作原料的原因是 ______。
作原料的原因是 ______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com