
科目: 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
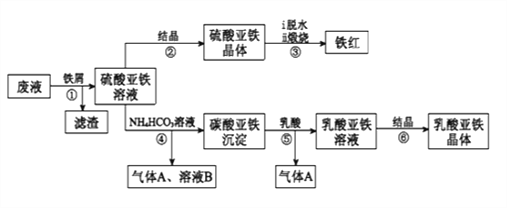
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______________(用a表示)。
查看答案和解析>>
科目: 来源: 题型:
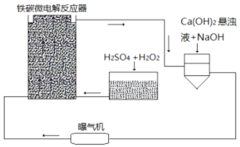
【题目】铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示。
请回答下列问题:
(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,这些微小电池的负极为______,若污水为酸性溶液,且通过曝气机鼓入充足的空气,正极反应式为:______。
(2)其治理污水原理主要有以下几个方面:
①一些不活泼的重金属离子被Fe置换出来。写出从![]() 中置换金的离子方程式______。
中置换金的离子方程式______。
②在处理过程中,有些胶体会发生电泳,向某极富集,从而聚沉除去。![]() 胶体电泳时,会向______极移动。
胶体电泳时,会向______极移动。
③吸附作用。Fe、C、![]() 、
、![]() 等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
等都有吸附作用,可以吸附一些悬浮物质。以上四种物质都有吸附性是因为______。
A.都有还原性![]() 表面积都很大
表面积都很大![]() 都含金属元素
都含金属元素![]() 都是胶体
都是胶体
④过程中产生的![]() 能沉淀或结合一些无机阴离子
能沉淀或结合一些无机阴离子![]() 例如
例如![]() 生成FeS沉淀
生成FeS沉淀![]() 。由FeS制备
。由FeS制备![]() 气体可选用______。
气体可选用______。
A.稀硫酸![]() 稀硝酸
稀硝酸![]() 稀盐酸
稀盐酸![]() 浓硫酸
浓硫酸
(3)溶液中的Fe元素最终均转化为![]() 沉淀除去。为更好除去
沉淀除去。为更好除去![]() 和
和![]() ,请参考装置图,从试剂用量角度提出可以采取哪些措施
,请参考装置图,从试剂用量角度提出可以采取哪些措施![]() 回答一条即可
回答一条即可![]() ______。
______。
(4)已知常温下,![]() ;
;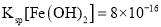 。
。
①计算![]() 的水解常数为______。
的水解常数为______。
②向饱和![]() 、
、![]() 混合溶液中,逐渐加入少量固体
混合溶液中,逐渐加入少量固体![]() 忽略体积和温度变化
忽略体积和温度变化![]() ,
,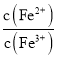 会______,
会______,![]() 选填“逐渐增大”、“逐渐减小”、“不变”
选填“逐渐增大”、“逐渐减小”、“不变”![]() 。结合相关数据推理说明原因______。
。结合相关数据推理说明原因______。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上可利用CO或CO2来生产燃料甲醇。
I.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
II.CO使其在一定条件下和H2反应制备甲醇,请根据图示回答下列问题:
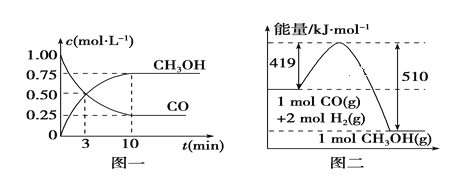
(1)写出制备甲醇的热化学方程式:__________________________________________
(2)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______________。
(3)某温度下,在一体积不变的密闭容器中充入2.5molCO、7.5molH2,达到平衡吋测得CO的转化率为90%,此时容器内的压强是起始的___________倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化硫酰![]() 主要用作氯化剂.它是一种无色液体,熔点
主要用作氯化剂.它是一种无色液体,熔点![]() ,沸点
,沸点![]() ,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
,遇水生成硫酸和氯化氢.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:![]()
(1)为了提高上述反应中![]() 的平衡转化率,下列措施合理的是 ______
的平衡转化率,下列措施合理的是 ______ ![]() 用编号填空
用编号填空![]() .
.
A.缩小容器体积![]() 使用催化剂
使用催化剂![]() 增加
增加![]() 浓度
浓度![]() 升高温度
升高温度
(2)![]() 时,体积为1L的密闭容器中充入
时,体积为1L的密闭容器中充入![]()
![]() ,达到平衡时容器中含
,达到平衡时容器中含![]()
![]() ,则
,则![]() 时合成
时合成![]() 反应的平衡常数为 ______ .
反应的平衡常数为 ______ .
(3)已知某温度下,已知![]() ,
,![]() ,在
,在![]() 溶于水所得溶液中逐滴加入
溶于水所得溶液中逐滴加入![]() 稀溶液,当
稀溶液,当![]() 浓度为
浓度为![]() 时,浑浊液中
时,浑浊液中![]() 浓度与
浓度与![]() 浓度之比为 ______ .
浓度之比为 ______ .
(4)将(2)所得的平衡混合气溶于足量的![]() 溶液中,计算最终生成沉淀的质量是多少
溶液中,计算最终生成沉淀的质量是多少![]() 写出计算过程
写出计算过程![]() .______ .
.______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在T农业生产中有重要的作用
(1)![]() 在空气屮灼烧可制得铁系氧化物材料。已知
在空气屮灼烧可制得铁系氧化物材料。已知![]() ,101kPa时:
,101kPa时:
![]()
![]()
![]()
![]()
写出![]() 在空气中灼烧生成
在空气中灼烧生成![]() 的热化学方程式______
的热化学方程式______
(2)生产中常用CO还原铁的氧化物冶炼铁。T业上可利用甲烷与水蒸气反应制备CO原料气:![]() 。如图是
。如图是![]() 与
与![]() 初始体积比为1:3时乎衡体系中甲烷的体积分数受温度、压强影响的关系图:
初始体积比为1:3时乎衡体系中甲烷的体积分数受温度、压强影响的关系图:
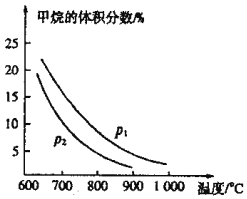
①甲烷与水蒸气反应制备CO的反应为______![]() 填“放热”或“吸热”
填“放热”或“吸热”![]() 反应,压强
反应,压强![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]()
②在恒温恒压的条件下,上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是______
A.逆反应速率先增大后减小
B.混合气体的密度减小
C.化学平衡常数K值减小
D.水蒸气的转化率减小
③在恒温、恒容的条件下,向上述平衡体系中充人体积比为:3的甲烷与水蒸气混合气体,再次达到平衡时CO的体积分数______![]() 填“增大”、减小”或“不变”
填“增大”、减小”或“不变”![]() ,
,
(3)已知![]() 时,
时,![]() ,该温度下反应
,该温度下反应![]() 的平衡常数
的平衡常数![]() ______
______
(4)工业上通过电解浓NaOH溶液可制备![]() ,然后转化为
,然后转化为![]() ,电解原理如图所示,则A溶液中溶质的成分为______
,电解原理如图所示,则A溶液中溶质的成分为______![]() 填化学式
填化学式![]() :阳极的电极反应式为______
:阳极的电极反应式为______
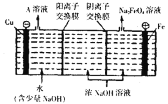 .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空:
(1)Al(OH)3酸式电离方程式:___________________________________
(2)用离子方程式分析Na2CO3溶液显碱性的主要原因:___________________________________
(3)CaCO3沉淀溶解平衡方程式:_____________________________________
(4)25℃时,四种溶液 ① pH=2的H2SO4溶液、②pH=12的Ba(OH)2溶液,③pH=4的NH4Cl溶液,④pH=12的CH3COONa溶液,水电离的c(H+)之比是______________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g) ![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是( )
A.反应在前50 s的平均反应速率为v(PCl3)=0.006 4 mol/(L·s)
B.相同温度下,起始时向该容器中充入2.0 mol PCl5、0.4 mol PCl3和0.40 mol Cl2,达到平衡前v(正)>v(逆)
C.相同温度下,起始时向该容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
D.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则反应的ΔH<0
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.![]() ,
,![]() 的反应,一定是自发反应
的反应,一定是自发反应
B.向AgI悬浊液中加人某浓度的KCl溶液,黄色沉淀转化为白色沉淀,说明![]()
C.碘化铅是一种难溶于水的金黄色粉末,常温下碘化铅饱和溶液呈金黄色
D.在相同很度下,HF的![]() 的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于
的Ka,则等物质量浓度的NaF与CH3COOK溶液相比较,NaF溶液的pH大于![]() 溶液的pH
溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】“变化观念与平衡思想”是化学学科的核心素养,室温时,0.1 mol·L1草酸钠溶液中存在多个平衡,其中有关说法正确的是[己知室温时,Ksp(CaC2O4)=2.4×109]
A. 若将溶液不断加水稀释,则水的电离程度增大
B. 溶液中各离子浓度大小关系:c(Na+)> c(C2O42)> c(OH)> c(H+)> c(HC2O4)
C. 若用pH计测得溶液的pH=9,则H2C2O4的第二级电离平衡常数Ka2=105
D. 向溶液中加入等体积CaCl2溶液,当加入的CaCl2溶液浓度大于2.4×108 mol·L1 时即能产生沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是![]()
选项 | 实验操作 | 实验目的或结论 |
A | 向含有少量 | 除去 |
B | 向某溶液中加入 | 证明溶液中含 |
C | 向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水,石灰水变浑浊 | 证明该溶液中存在 |
D | 向 | 证明 |
A.AB.BC.CD.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com