
科目: 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
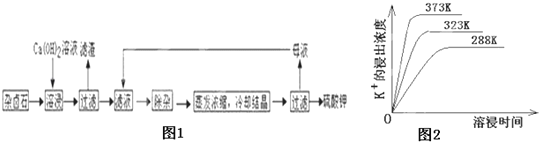
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种有机物,它们有如下相互转化关系:
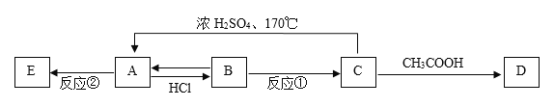
已知:A是相对分子质量为28的烃,E属于高分子化合物。请完成下列各题:
(1)物质A的名称是______________,物质D的结构简式为____________________。
(2)写出反应①的化学方程式:_______,该反应属于_____________反应。
(3)写出反应②的化学方程式:______________,该反应属于_____________反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】脱硝技术是处理氮氧化物的有效方法之一。在1L的恒容密闭容器中充入2mol NH3、1mol NO和1mol NO2,发生反应:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
2N2(g)+3H2O(g)△H。在不同温度下发生上述反应,测得N2的物质的量(mol)与时间的关系如下表:
0 | 10 min | 20 min | 30 min | 40 min | |
T1K | 0 | 0.6 | 1.1 | 1.5 | 1.5 |
T2K | 0 | 0.8 | 1.4 | 1.4 | 1.4 |
回答下列问题:
(1)上述反应中___________(填字母)。
A. △S>0,△H>0 B. △S>0,△H<0 C. △S<0,△H>0 D. △S<0,△H<0
(2)T1_______(填“>”“<”或“=”)T2,理由是___________________________________________
(3)T1K下,0~20min内v(NO)=______________
(4)T2K下,NO2的平衡转化率为_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为V L的恒容密闭容器中通入1 mol CH3Cl(g)和1 mol H2O(g),体系内同时存在下列两个平衡:
反应①:CH3Cl(g)+H2O(g)![]() CH3OH(g)+HCl(g) K1
CH3OH(g)+HCl(g) K1
反应②:2CH3OH(g)![]() (CH3)2O(g)+H2O(g) K2
(CH3)2O(g)+H2O(g) K2
反应t min后体系达到平衡,此时(CH3)2O(g)的物质的量为9×10-3mol,CH3Cl(g)的平衡转化率为4.8%,回答下列问题:
(1)0~t min内,CH3Cl(g)的反应速率为___________。
(2)反应达到平衡时,CH3OH(g)的物质的量为___________。
(3)计算反应②的平衡常数K2=___________。
(4)当反应到达平衡时,再向体系内通入一定量的CH3OH(g),下列说法正确的是________(填字母)。
A.反应①的平衡逆向移动,反应②的平衡不发生移动
B.平衡时反应①、反应②的反应速率都增大
C.K1增大,K2减小
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 17 g羟基(—OH)所含有的电子数是10NA个
B. 1 mol苯乙烯中含有的碳碳双键数为4NA个
C. 常温下,14 g乙烯和丙烯的混合物中总原子数为3NA个
D. 4.2 g C3H6中含有的碳碳双键数一定为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
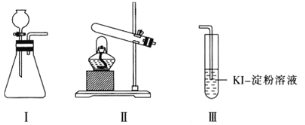
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的____中加入质量分数为30%的H2O2溶液,连接装置I、III,打开活塞 | 装置I中产生无色气体并伴随大量白雾;装置III中有气泡冒出,溶液迅速变蓝 |
乙 | 向装置II中加入KMnO4固体,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液不变蓝 |
丙 | 向装置II中加入____,向装置III中再加入适量0.1mol·L-1的H2SO4溶液,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式为___________________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________________________。
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入_________(填字母)溶液中,依据实验现象来证明白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应___________________________________(写离子方程式)造成的,请设计实验证明他们的猜想是否正确:___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某含镍![]() 废料中有FeO、
废料中有FeO、![]() 、MgO、
、MgO、![]() 等杂质,用此废料提取
等杂质,用此废料提取![]() 的工艺流程如图1:
的工艺流程如图1:
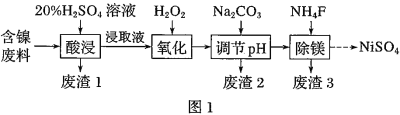
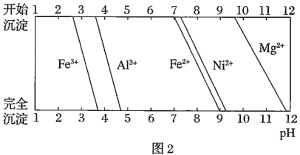
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②![]() 时,
时,![]() 的电离常数
的电离常数![]() 的电离常数
的电离常数![]() ,
,![]()
![]() .
.
(1)加![]() 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______![]() 填化学式
填化学式![]() .
.
(2)![]() 能与饱和
能与饱和![]() 溶液反应产生
溶液反应产生![]() ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释![]() 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答![]() ______.
______.
(3)![]() 时,
时,![]() 的NaF溶液中
的NaF溶液中![]() ______
______![]() 列出计算式即可
列出计算式即可![]() 溶液呈______
溶液呈______![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() .
.
(4)已知沉淀前溶液中![]() ,当除镁率达到
,当除镁率达到![]() 时,溶液中
时,溶液中![]() ______
______![]() .
.
(5)在NaOH溶液中用NaClO与![]() 反应可得
反应可得![]() ,化学方程式为____________;
,化学方程式为____________;![]() 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池![]() 溶液
溶液![]() ,工作原理为:
,工作原理为:![]() ,负极的电极反应式:______.
,负极的电极反应式:______.
查看答案和解析>>
科目: 来源: 题型:
【题目】铬铁矿主要含有亚铬酸亚铁![]() ,还含有少量
,还含有少量![]() 和
和![]() 。由铬铁矿制备
。由铬铁矿制备![]() 的流程如图1所示:
的流程如图1所示:
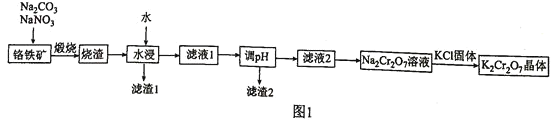
已知:常温下,![]() ,
,![]() 。
。
回答下列问题:
(1)铬铁矿与![]() 、
、![]() 混合煅烧之前应先将其粉碎,目的是_______________。
混合煅烧之前应先将其粉碎,目的是_______________。
(2) “煅烧”过程中主要反应的化学方程式为_______![]() _______
_______![]() _______
_______![]() _______
_______![]() _______
_______![]() _______
_______![]() _______
_______![]() 。
。
(3)已知:![]() 和
和![]() 与
与![]() 高温煅烧可生成
高温煅烧可生成![]() 和
和![]() 。“滤渣1”的主要成分为_____________________
。“滤渣1”的主要成分为_____________________![]() 填化学式
填化学式![]() ,其一种用途为_____________________
,其一种用途为_____________________
(4)“调pH”的过程即是用酸酸化使pH约为5,其目的是_____________________,“滤渣2”的主要成分为_____________________![]() 填化学式
填化学式![]() ,同时
,同时![]() 转化为
转化为![]() ,此转化过程的离子方程式为____________________________。
,此转化过程的离子方程式为____________________________。
(5)![]() 、KCl、
、KCl、![]() 、NaCl的溶解度曲线如图2所示,结合图象解释向
、NaCl的溶解度曲线如图2所示,结合图象解释向![]() 溶液中加入KCl固体经一系列操作后得到
溶液中加入KCl固体经一系列操作后得到![]() 的理由:_____________________________。
的理由:_____________________________。
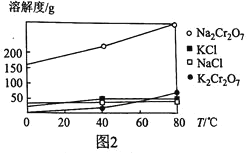
(6)该流程产生的含铬废水不能随意排放,可通过电解法处理![]() 装置如图3所示
装置如图3所示![]() ,电解时,在阴极区可生成
,电解时,在阴极区可生成![]() 和
和![]() 沉淀,电解后溶液中
沉淀,电解后溶液中![]() ,则溶液中
,则溶液中![]() ____________
____________![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
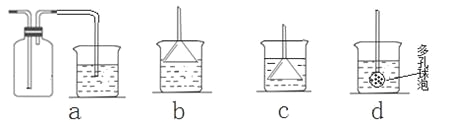
【题目】纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
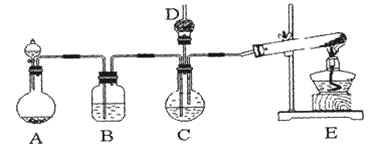
(1)A中制备气体时,所需药品是(选填字母序号)______________;
(2)B中盛有饱和碳酸氢钠溶液,其作用是______________________________;
(3)写出制取氨气的化学方程式__________________________________;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式______________;
(5)检验D出口处是否有氨气逸出的方法是__________________________;
(6)写出制纳米级碳酸钙的化学方程式______________________________。
(7)若实验过程中有氨气逸出,应选用下列_____________装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
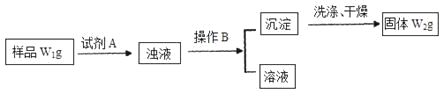
试回答:
(1)所加试剂A的化学式为______________________________________;
(2)B操作方法是_______________________________________________;
(3)样品中氯化铵的质量分数为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com