
科目: 来源: 题型:
【题目】钛酸钡(BaTiO3)是一种强介电化合物,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶 瓷工业的支柱”。
Ⅰ、固相合成法是钛酸钡的传统制备方法,典型的工艺是将等物质的量的碳酸钡和二氧化钛混合,在1500℃下反应 24 小时。
(1)写出发生反应的化学方程式:_____。
(2)该工艺的优点为工艺简单,不足之处为_____。
Ⅱ、工业上还可以 BaCO3、TiCl4 为原料,采用草酸盐共沉淀法制备草酸氧钛钡晶体[BaTiO(C2O4)24H2O],再高温煅烧制得钛酸钡粉末,其制备工业流程如图所示。
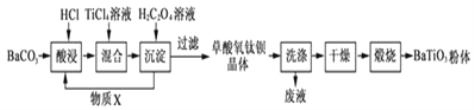
(3)为提高 BaCO3 的酸浸率,可采取的措施为_____ (任答一点)。
(4)加入 H2C2O4 溶液时,可循环使用的物质 X 是_____。
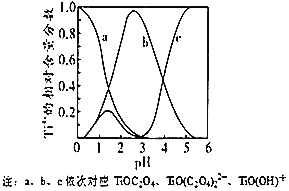
(5)研究表明,钛离子在不同 pH 下可以 TiO(OH)+、TiOC2O4 或 TiO(C2O4)2等形式存在(如图),所以在制备草酸氧钛钡晶体时要用到氨水调节混合溶液的 pH. 请结合图示信息分析,混合溶液的最佳 pH 为_____左右。
(6)高温煅烧草酸氧钛钡晶体[BaTiO(C2O4)24H2O]得到 BaTiO3 的同时,生成高温气体产物有 CO、_____和_____。成都七中某兴趣小组在实验室里模拟“高温煅烧”操作时所使用的陶瓷仪器有_____。
(7)将 TiCl4 水解产物加热脱水可生成 TiO2,写出 TiCl4 水解的化学方程式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙烯醇具有亲水性和成膜性,在适宜的浓度下,能起类似人工泪液的作用,作为润滑剂预防或治疗眼部刺激症状。聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)![]() CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
CH3COOC6H13(l)+CH3OH(l),已知v正=k正x(CH3COOCH3)x(C6H13OH),v逆=k逆x(CH3COOC6H13)x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)“洗衣凝珠”是由一层薄膜包裹洗衣液制成的新型洗涤产品,该薄膜的主要化学成分是可溶于水的聚乙烯醇(简称PVA)塑料,聚乙烯醇的化学式为(C2H4O)n,试回答:聚乙烯醇属于_____(填“金属材料”、“有机合成材料”、“硅酸盐材料”、“复合材料”之一),从物质结构的角度解释聚乙烯醇具有亲水性的原因___________________________。
(2)343K时,乙酸甲酯和己醇按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___(填增大、减小或不变)。
(3)反应开始时,已醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____(保留2位有效数字)。A、B、C、D四点中,v逆最大的是___,v正最大的是____。
(4)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____。
a.参与了醇解反应,但并不改变反应历程 b.提高乙酸甲酯的平衡转化率
c.提高了醇解反应的活化能 d.使k正和k逆增大相同倍数
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)利用水煤气合成二甲醚的总反应为:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
CH3OCH3(g)+CO2(g);ΔH=-246.4 kJ·mol-1 它可以分为两步,反应分别如下:
①4H2(g)+2CO(g)===CH3OCH3(g)+H2O(g), ΔH1=-205.1 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g);ΔH2=________。
(2)在一定条件下的密闭容器中,该总反应达到平衡,只改变一个条件能同时提高反应速率和CO转化率的是________(填字母代号)。
A.降低温度 B.加入催化剂
C.缩小容器体积 D.增加H2的浓度
E.增加CO的浓度
(3)在一体积可变的密闭容器中充入3 mol H2、3 mol CO、1 mol CH3OCH3、1 mol CO2,在一定温度和压强下发生反应:3H2(g)+3CO(g)![]() CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
CH3OCH3(g)+CO2(g),经一定时间达到平衡,并测得平衡时混合气体密度是同温同压下起始时的1.6倍。
问:①反应开始时正、逆反应速率的大小:v(正)______(填“>”、“<”或“=”)v(逆)。
②平衡时n(CH3OCH3)=________,平衡时CO的转化率=________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,几种物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp |
|
|
|
|
(1)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜先加入_______(填试剂分子式),然后调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。
(2)在有CuCl与CuI固体共存的悬浊液中,C(Cl-)______C(I-)(填 > < =)
某溶液中C(Cl-)为0.0001 mol·L-1, C(I-)为0.1 mol·L-1,往溶液中滴加硝酸亚铜,先产生的沉淀是__________(填沉淀化学式)
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修3:物质结构与性质]铬元素在地壳中含量占第21位,是一种重要的金属。回答下列问题:
(1)基态铬原子的价电子排布式为_________________,根据价层电子判断铬元素中最高价态为___________价。铬元素的第二电离能________锰元素的第二电离能(填“>”“<”填“=”)。
(2)无水氯化亚铬(CrCl2)的制备方法为在500℃时用含HCl的H2气流还原CrCl3,该过程涉及到的反应原理为____________________________________________(用化学方程式表示)。
已知:氯化亚铬的熔点为820~824℃,则其晶体类型为___________晶体。二价铬还能与乙酸根形成配合物,在乙酸根中碳原子的杂化形式为___________
(3)已知CrO5中铬元素为最高价态,画出其结构式:______________________
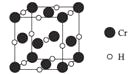
(4)Cr元素与H元素形成化合物的晶胞结构如图所示,则该化合物的化学式为___________。已知:该晶胞的边长为437.6 pm,NA表示阿伏加德罗常数的值,则晶体的密度为____g/cm3(列出计算式即可)。
查看答案和解析>>
科目: 来源: 题型:
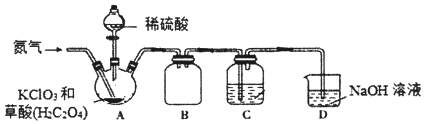
【题目】二氧化氯(C1O2)是一种黄绿色气体,沸点为11℃,不稳定,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。C1O2易溶于水但不与水反应,其水溶液在温度过高时有可能爆炸。某小组按照以下实验装置制备C1O2并验证其某些性质。
请回答下列问题:
(1)实验时A装置需要控制温度为60~80℃,则A装置加热的方式是___,该加热方式的优点是_____。
(2)通入氨气的主要作用有两个,一是可以起到搅拌作用,二是____。
(3)B装置的作用是___。C装置用来吸收C1O2,则C中液体易选用下列___(填序号)。
①热水 ②冰水 ③饱和食盐水
(4)装置D中C1O2与NaOH溶液反应可生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中生成这两种钠盐的化学方程式为____。饱和NaClO2溶液在温度低于38℃时析出晶体NaC1O23H2O,在温度高于38℃时析出晶体NaClO2.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.___;b.___;c.洗涤;d.干燥。
(5)设计一个简易实验证明二氧化氯具有永久的漂白性:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.NaHS溶液中:K+、S2-、SO42-、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,7.8g乙炔和苯的混合物中含C—H键数目为0.6NA
B.10g46%的乙醇溶液中,含H—O键的数目为0.1NA
C.1L0.1mol·L1 FeCl3溶液中含Fe3+数目为0.1NA
D.将1molNH3通入足量水中,NH3 ·H2O、NH4+ 粒子数目之和为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1 = 1.1×10-5 ,Ka2 = 1.3×10-8。下列叙述正确的是( )
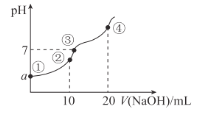
A.从点①到点④过程中水的电离程度先增大后减小
B.点②处c(Na+) + 2c(H+) + c(H2X) =2 c(X2-) + c(HX-) + 2c(OH-)
C.a近似等于3
D.点④处c(Na+) = 2 c(X2-) > c(OH-) > c(HX-) > c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,又称保险粉,是一种白色粉末,易溶于水,但不溶于乙醇,在碱性介质中稳定。
(1)Na2S2O4中S元素的化合价为____。
(2)连二亚硫酸钠在潮湿空气中极不稳定,易分解并引起燃烧,甚至发生爆炸,反应的化学方程式为:2Na2S2O4=Na2S2O3+Na2SO3+___。保存“保险粉”时常加入少量Na2CO3固体,目的是___。
(3)Na2S2O4暴露于空气中易吸收氧气和水蒸气而变质,当氧化剂和还原剂的物质的量之比为1:2时,反应产物的化学式为____。
(4)工业上可用如图装置电解NaHSO3和NaC1溶液制Na2S2O4。总反应为:2NaHSO3+2NaC1![]() Na2S2O4+2NaOH+C12↑
Na2S2O4+2NaOH+C12↑

①惰性电极a连接电源的____(填“正极”或“负极”),其电极反应式为____;
②若不加隔膜,则连二亚硫酸钠产率降低,其原因是____。
向银离子的乙二胺四乙酸(EDTA)配合物溶液中,滴加用NaOH碱化的连二亚硫酸钠溶液可生成纳米级银粉,该方法能用来测定Na2S2O4纯度,其反应原理可简单表示为:2Ag++S2O42-+4OH-=2Ag↓+2SO32-+2H2O。现取5.000g粗产品用上述方法测定纯度,将制得纳米级银过滤、洗涤、干燥、称量,其质量为4.320g。计算粗产品中连二亚硫酸钠的质量分数为____。测得连二亚硫酸钠的纯度比实际值小,若排除实验过程中的操作误差,分析可能的原因是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com