
科目: 来源: 题型:
【题目】某课外活动小组的同学在学习了电化学相关知识后,用如图装置进行实验,请回答下列问题:
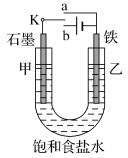
(1)实验一:将开关K与a连接,则乙电极上的反应式为___________________________________。
(2)实验一结束后,该研究小组的同学决定在乙电极表面上镀金属锌以防止铁被腐蚀,这种金属保护的原理名称是______________________。
(3)实验二:开关K与b连接,则甲为________极(填“正”“负”“阳”或“阴”);
(4)对于实验二,下列说法正确的是________(填字母编号)。
A.溶液中Na+向甲极移动
B.从甲极处逸出的气体能使湿润的淀粉-KI试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(5)当乙电极产生标准状况下224 mL气体,若剩余溶液体积为200 mL,则电解后所得溶液在常温下的pH为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:气体A的饱和溶液![]() A和食盐的饱和溶液
A和食盐的饱和溶液![]() 悬浊液
悬浊液![]() 晶体
晶体![]() 纯碱,则下列叙述错误的是( )
纯碱,则下列叙述错误的是( )
A.A气体是CO2,B气体是NH3
B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化钡(Ba3N2)是一种重要的化学试剂。高温下,向氢化钡(BaH2)中通入氮气反应可制得氮化钡。已知:Ba3N2遇水反应;BaH2在潮湿空气中能自燃,遇水反应。用图示装置制备氮化钡时,下列说法不正确的是( )

A.装置乙中反应的化学方程式为NaNO2+NH4Cl![]() N2↑+NaCl+2H2O
N2↑+NaCl+2H2O
B.气流由左向右的字母连接顺序为c→a→b→d→e→g→f
C.实验时,先点燃装置乙中的酒精灯,反应一段时间后,再点燃装置丙中的酒精喷灯进行反应
D.装置甲中的浓硫酸和装置丁中的碱石灰都是用于吸收水蒸气,防止水蒸气进入装置丙中
查看答案和解析>>
科目: 来源: 题型:
【题目】N2与H2反应生成NH3的过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1 mol N2和3 mol H2,使反应N2+3H2![]() 2NH3达到平衡,测得反应放出热量为Q1。
2NH3达到平衡,测得反应放出热量为Q1。
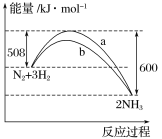
(1)该反应的热化学方程式为__________________________。
(2)Q1________92 kJ(填“>”“<”或“=”)。
(3)曲线a和曲线b中,加了催化剂的是________。
(4)上述反应达到平衡后,升高温度H2的转化率________(填“增大”“不变”或“减小”)。
(5)在温度体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则2Q1与Q2的关系为: Q2 ______2Q1(“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】向一定量的铁、氧化亚铁和氧化铁的混合粉末中,加入100ml2mol/L的盐酸,恰好使混合物完全溶解,并放出448ml的气体(SPT),在所得溶液中加入KSCN溶液无血红色出现.若用相同质量的上述混合物粉末高温下同足量的一氧化碳反应,可得到铁的质量是( )
A.无法计算B.2.8gC.5.6gD.11.2g
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度 ②适当增大压强
③不断分离出产物C ④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则![]() ________
________![]() (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的5种短周期主族元素;原子半径按D、E、B、C、A顺序依次减小,B和E是同主族元素。
(1)下列推断正确的是________。
a A、B、E不可能在同一主族
b A、B、C可能在同一周期
c C的最高价氧化物的水化物可能显碱性
d C和D的单质可能生成离子化合物
(2)若A与D同主族,B属非金属元素,它的一种单质是电的良导体,C原子的最外层电子数比A与B的最外层电子数总和还多1。则①A与C元素按原子个数比1:1形成的化合物F的电子式为______;F属于__________分子(填“极性”或“非极性”)
②由A、B、C、D四元素按原子个数比1:1:3:1形成的化合物为_________,它与A、C、D形成的化合物在水溶液中反应的离子方程式为_______;
③E在周期表中的位置 ______ C和E形成的化合物属于_____晶体
④由A、B、C元素中的两种或三种可以组成多种分子,其中含有18个电子的分子是____(填化学式)。
⑤B、C、E氢化物的沸点由高到低为__________,试说明原因 _____。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z位于三个不同的周期,W与Y同主族,X 与 Z 的核外电子数之和是Y的核外电子数的2倍。化合物甲的结构式如图所示,甲不溶于水。下列说法正确的是( )
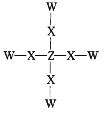
A.简单离子半径:Y>X
B.非金属性:Z>X
C.化合物甲中每个原子都达到了8电子稳定结构
D.由 W、X、Y 三种元素形成的化合物的水溶液能与 Z 的单质反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14g由C2H4和N2组成的混合气体中所含质子总数一定为7.5NA
B.1molP4S3( )中所含P—S键的数目为9NA
)中所含P—S键的数目为9NA
C.1L0.1mol·L-1NaHSO3溶液中所含阳离子的总数大于0.1NA
D.11.2LCl2与足量乙烷在光照条件下反应产生HCl分子的总数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】四种短周期元素A、B、C、D原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两种元素原子最外层电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它电子层数的2倍,A和C可以形成化合物CA3,B与D的原子序数之比为3∶4。请回答:
(1)化合物CA3的化学式是__________。
(2)写出A和C化合生成CA3反应的平衡常数表达式_________。在一定条件下要使该反应平衡向右移动,可采取的措施有________。
A 缩小反应容器容积 B 增大反应容器容积
C 使用合适的催化剂 D 及时分离出生成物
(3)由四种元素中的三种元素组成的物质甲属于盐类,其水溶液呈酸性,请用离子方程式表示其呈酸性的原因__________,若用pH试纸测定0.1 mol/L的甲溶液的pH,实验操作是__________
(4)乙和丙为含有上述四种元素的常见无机盐,二者均既可与盐酸又可与烧碱溶液反应。则乙和丙的化学式为乙:___________;丙__________。
(5)写出乙溶液与硫酸氢钠溶液反应的离子方程式_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com