
科目: 来源: 题型:
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应可能是自发进行的吸热反应的是( )
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
B.(NH4)2CO3(s)=NH4HCO3(g)+NH3(g)
C.2CO(g)+O2(g)![]() 2CO2(g)
2CO2(g)
D.2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
查看答案和解析>>
科目: 来源: 题型:
【题目】煤的气化就是将煤转化为可燃气体的过程。水蒸气通过灼热的煤所产生的混和气,其主要成份是CO、H2还含有CO2和水蒸气。用下列装置检验混和气中部分物质,下列说法不正确的是( )
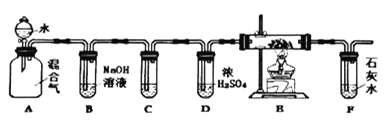
A.若A和B之间增加装无水CuSO4的干燥管可检验H2O的存在
B.若试管C和E中分别装澄清石灰水、CuO,可检验CO的存在
C.在装置F之后,应该放置一只燃着的酒精灯,防止CO污染空气
D.工业上将煤气化,其目的是获得洁净的燃料和化工原料
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应N2O4(g)![]() 2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
2NO2(g)在温度一定时,平衡体系中NO2的体积分数φ(NO2)随压强的变化情况如图所示(实线上任何一点为对应压强下的平衡点),下列说法正确的是( )
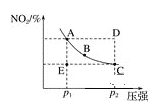
A. A、C两点的正反应速率的关系为A>C
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压到p2,再由p2无限缓慢降压至p1
D. 维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y;则x<y
查看答案和解析>>
科目: 来源: 题型:
【题目】根据侯氏制碱原理是:NaCl+H2O+NH3+CO2=NH4Cl+NaHCO3↓,2NaHCO3![]() Na2CO3+H2O+CO2↑,实验室利用侯氏制碱原理制备少量NaHCO3的实验,需要经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
Na2CO3+H2O+CO2↑,实验室利用侯氏制碱原理制备少量NaHCO3的实验,需要经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法不正确的是( )
A.常温下,18gH2O中电子数均为10NA
B.标准状况下,2molSO2和1molO2充分反应生成SO2的数目为2NA
C.常温下,1L1mol·L-1Na2CO3溶液中,阴离子数目大于NA
D.1molCl2与FeCl2溶液完全与反应,转移电子的数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料,设计资源回收的工艺流程如图:
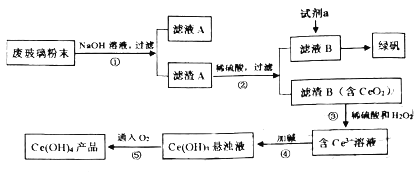
(1)写出第①步反应的离子方程式__。滤液A中的用途是___。
(2)向滤液B中加入过量试剂a可用于制备绿矾(FeSO4·7H2O),试剂a是__(填物质名称)充分反应后,经过滤得到FeSO4溶液。再经蒸发浓缩、冷却结晶、过滤、洗涤等操作步骤得到绿矾。检验所加试剂a已经过量,使用的试剂和判断的依据分别是__、__。
(3)写出第③步反应的化学方程式__。
(4)取上述流程中得到的Ce(OH)4[摩尔质量为208g·mol-1产品0.500g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定(铈被还原为Ce3+)消耗20.00mL标准溶液,该产品中Ce(OH)4的质量分数为__(保留四位有效数字数)。若FeSO4标准溶液部分变质,会使测定结果__。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化锌是一种无毒的无机化合物,可用于生产婴儿爽身粉。锌焙砂主要含ZnO、ZnFe2O4,还含有少量Al2O3、FeO、Fe2O3、CuO、SiO2等氧化物。如图是工业上利用锌焙砂制取氧化锌的流程图。
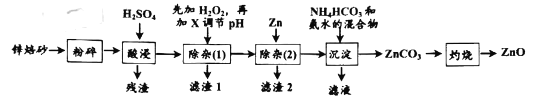
已知:几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Zn(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 4.2 | 6.4 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 6.7 | 8.0 |
回答下列问题:
(1)ZnFe2O4中铁的化合价是__,H2O2的电子式为___。
(2)“酸浸”时ZnFe2O4会生成两种盐,该反应的化学方程式为__。
(3)“除杂(1)”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)__,为了加快反应速率,可适当加热。加入的H2O2溶液比预计的要多了许多,原因是:__;需要调节的pH的范围是__,所加的试剂X是__(填化学式)
(4)“沉淀”时,需要控制温度在40℃,目的是:__。
(5)“滤液”中溶质的主要成份是__(写化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
A. 1.6 mol SO2+0.3 mol O2+0.4 mol SO3
B. 4.0 mol SO2+1.0 mol O2
C. 2.0 mol SO2+1.0 mol O2+2.0 mol SO3
D. 2.0 mol SO2+0.5 mol O2+1.0 mol SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25 ℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:_________________。
(2)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ/mol
2CO(g)+O2(g)=2CO2(g) ΔH=﹣566 kJ/mol
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______________________。
(3)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应如6Ag(s)+O3(g)=3Ag2O(s) ΔH=﹣235.8 kJ/mol,
已知:2Ag2O(s)=4Ag(s)+O2(g) ΔH= +62.2 kJ/mol,则O3转化为O2的热化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com