
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下:
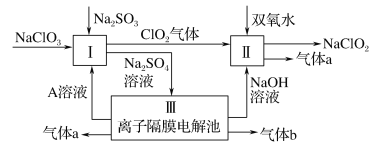
(1)Ⅰ中发生反应的还原剂是____ (填化学式)。
(2)Ⅱ中反应的离子方程式是____。
(3)Ⅲ中离子隔膜电解池的装置如下:
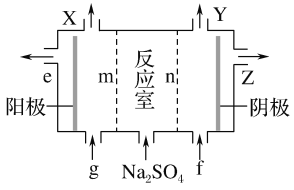
①A的化学式是________,A在____口产生。
②m为____ (填“阴”或“阳”)离子交换膜。
③结合化学用语和文字说明解释NaOH产生的原因:________
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
①该反应中氧化剂和还原剂的物质的量之比是____。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是____。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量前者____ (填“>”“<”或“=”)后者。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
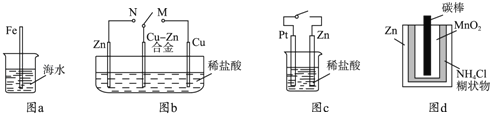
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
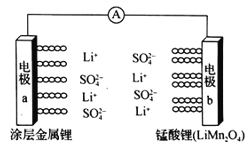
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液里存在重要的酸碱平衡:![]() ,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随![]() 变化关系如下表:
变化关系如下表:
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
下列说法不正确的是
A. 正常人体血液中, ![]() 的水解程度大于电离程度
的水解程度大于电离程度
B. 人体血液酸中毒时,可注射![]() 溶液缓解
溶液缓解
C. ![]() 的血液中,
的血液中, ![]()
D. pH=7.40的血液中, ![]() 的水解程度一定大于
的水解程度一定大于![]() 的电离程度
的电离程度
查看答案和解析>>
科目: 来源: 题型:
【题目】铁红(Fe2O3)和钛白粉(TiO2)均为重要的墙面装修颜料。一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示:
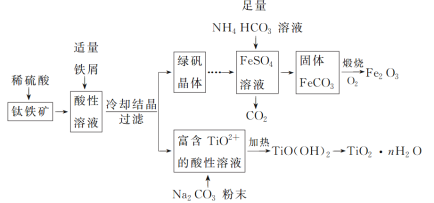
回答下列问题:
(1)FeTiO3中Fe的化合价为_______。
(2)为加快钛铁矿在稀硫酸中的溶解,可采取的措施有_______ (任写两种)。酸性溶液中加入适量铁屑的目的是将_______。
(3)FeSO4溶液与NH4HCO3溶液的反应温度应控制在35 ℃以下,其原因是_______,该反应的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O。
(4)TiO2+转化为TiO(OH)2需要加热,加热的目的是_______,该反应的离子方程式为TiO2++2H2O![]() TiO(OH)2↓+2H+。
TiO(OH)2↓+2H+。
(5)常温时,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO32-)=3.0×10-6 mol·L-1,pH为8.5,则所得的FeCO3中是否含Fe(OH)2_______?
查看答案和解析>>
科目: 来源: 题型:
【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
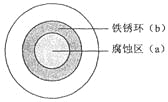
A.液滴中的Cl–由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图所示。下列说法不正确的是
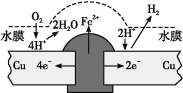
A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀
B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小
C.铜极上的反应是2H++2e =H2↑、O2+4e+4H+=2H2O
D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀
查看答案和解析>>
科目: 来源: 题型:
【题目】薄荷油中含有少量a—非兰烃,其相对分子质量为 136。根据如下转化,回答相关问题。
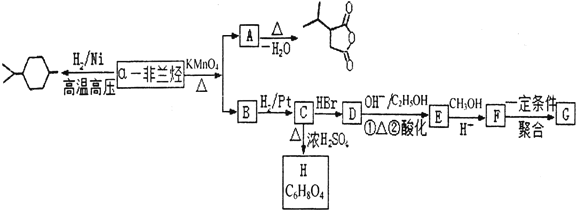
已知:Ⅰ. ![]()
![]()
![]() +RCOOH
+RCOOH
Ⅱ. ![]()
![]()
![]() +CO2
+CO2
Ⅲ.2CH3COOH![]()
![]()
(1)a—非兰烃的结构简式为______。
(2)B 中含有的官能团名称为______,C→D 的反应类型为______。
(3)C→H 的反应方程式为______。
(4)写出符合下列条件 A 的同分异构体______(写三种即可)。
①含有 4 个—CH3②1mol 此同分异构体在碱性条件下水解需 2mol NaOH。
(5)以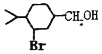 为原料合成
为原料合成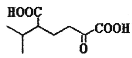 ______。(用流程图表示,其他无机试剂任选)
______。(用流程图表示,其他无机试剂任选)
查看答案和解析>>
科目: 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
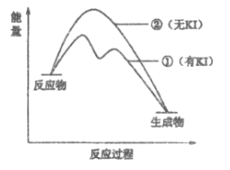
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:
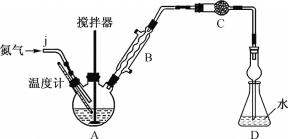
(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。
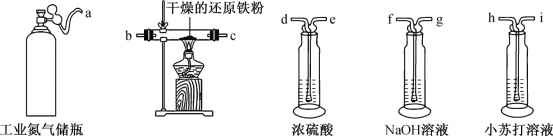
②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com