
科目: 来源: 题型:
【题目】工业制硫酸的尾气中含有一定量SO2,处理尾气的手段除了氨吸收法以外还有以下几种方法。
(一)工业实际吸收过程中,第Ⅰ步常采用浓苛性钠溶液吸收为其中的SO2,然后向生成溶液中加入熟石灰,充分反应后将生成产物分离后再经氟化后制得产品A。
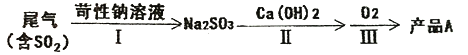
(1)产品A是_______(填化学式)。
(2)有人提出将第一步中的浓苛性钠溶液换成同温度下饱和Ca(OH)2溶液直接制得产品CaSO3,你认为是否可行?_______(填“可以”、“不可以”或“不确定”)原因是_______。
(二)制备MnSO4H2O:SO2还原MnO2矿制备MnSO4H2O,过程如下:

己知25℃时部分物质的溶度积常数如下表:
物质 | Mn(OH)2 | Fe(OH)3 | Cu(OH)2 | MnS | FeS | CuS |
溶度积 | 2.1×10-13 | 4.0× 10-38 | 2.2×10-23 | 1.0×10-11 | 6.3×10-18 | 6.3×10-38 |
(3)还原时,若尾气中SO2含量为4.48%,除去标况下lm3尾气至少需要含锰质量分数为55%的MnO2 矿粉_______g。
(4)除铁时加入碳酸钙,发生的反应的离子反应方程式为_____________________。
(5)试剂A最好是______________(写化学式)。
(6)操作I的名称为_________________。MnSO4H2O在1150℃高温下易分解,产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,HNO2的电离常数Ka=7.1×10-4,NH3·H2O的电离常数Kb=1.7×10-5。0.1 mol·L-1 NH4NO2溶液中,离子浓度由大到小的顺序是__________,常温下NO2-水解反应的平衡常数Kh=_______(保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】构成原电池的条件有很多,其中一种就是利用电解质的浓度差构成“浓差电池”。当电解质中某离子的浓度越大时其氧化性或还原性越强。如图,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K2,断开K1,发现电流计指针发生偏转。下列说法不正确的是

A. 一段时间后电流计指针将归零,此时可视为反应不再进行
B. 当电流计指针归零后,闭合K1,断开K2后,乙池溶液浓度上升
C. 当电流计指针归零后,闭合K1,断开K2后,乙中Ag电极质量增加
D. 实验开始先闭合K2,断开K1,此时NO3-向B电极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):

下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙烯醇肉桂酸酯(M)可用作光刻工艺中的抗腐蚀涂层,其合成路线如下:

已知:R1—CHO+R2—CH2CHO![]() CHOHR1CHCHOR2
CHOHR1CHCHOR2
请回答:
(1)C的化学名称为______________;M中含氧官能团的名称为____________。
(2)F→G的反应类型为__________;
检验产物G中新生成官能团的实验方法为______________________________。
(3)C→D的化学方程式为________________________________________。
(4)E的结构简式为_______________________;
H的顺式结构简式为_____________________________。
(5)同时满足下列条件的F的同分异构体有________种(不考虑立体异构);
①属于芳香族化合物 ②能发生水解反应和银镜反应
其中核磁共振氢谱有4种吸收峰的物质的结构简式为_________________(任写一种)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯磺酸(HSO3Cl)是无色液体,密度为1.79gcm-3,其沸点约152℃:氯磺酸有强腐蚀性,遇潮湿空气生成浓烈的白雾,它属于危险品。制取氯碘酸是在常温下将干燥的氯化氢气体通入溶有三氧化硫的硫酸(发烟硫酸)中,氯化氢与三氧化硫化合即得氯磺酸。在实验室里制取氯磺酸可用如图所示的装置(图中衬垫、夹持和固定仪器均已略去)。
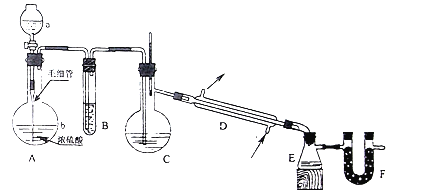
所用到的试剂有:①密度为1.19gcm-3的浓盐酸;②密度为1.84gcm-3质量分数为98.3%的浓硫酸(98.3%的浓硫酸沸点是338℃;③发烟硫酸;④无水氯化钙:⑤水;⑥碱石灰。试填空:
(1)对应仪器中应盛入的试剂或药品(填名称):
a中为______,B中为______,C中为______,F中为______;
(2)A中的分液漏斗下端接有的毛细管的作用是:______,若不用毛细管直接用分液漏斗注入a中液体,可能发生的现象是______,利用生活用品改进实验装置,若将分液漏斗换为______,还能更好的控制反应发生;
(3)写出实验室制备氯磺酸的化学方程式______,一定程度时需用酒精灯在C装置下加热的作用是:______;
(4)如果C中的温度计换成温度传感器,作用是:______;
(5)如果不加F装置可能产生大量烟雾,用化学用语解释原因______;
(6)若F中加无水氯化钙,F后______(填有或没有)必要加装HCl的吸收装置。
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物具有广泛的应用,间接碘量法可以测定铜合金中的铜,回答下列问题:
(1)铜合金的种类较多,主要有黄铜和各种青铜等。试样可以用HNO3分解,还需要用到浓H2SO4.CuSO4和Cu(NO3)2中阳离子的基态核外电子排布式为______;S、O、N三种元素的第一电离能由大到小的顺序为______;
(2)Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2,其中NH3中心原子的杂化轨道类型为______,[Cu(NH3)4](NO3)2属于______晶体。
(3)CuSO4溶液中加入过量KCN能生成配离子[Cu(CN)4]2-,1 mol CN-中含有的π键数目为______,与CN-互为等电子体的离子有______(写出一种即可);
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因可能是______;
(5)在弱酸性溶液中,Cu2+与过量KI作用,生成CuI沉淀,同时析出定量的I2;如图为碘晶体晶胞结构。下列有关说法中正确的是______;
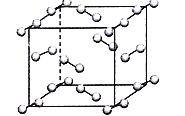
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子,以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
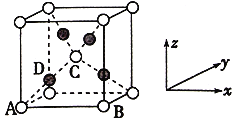
(6)已知Cu2O晶胞结构如图所示,该晶胞原子坐标参数A为(0,0,0),B为(1,0,0),C为(![]() )。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
)。则D原子的坐标参致为______,它代表______原子(填元素符号);已知金属铜的堆积方式是面心立方最密堆积,则晶体中铜原子的配位数是12,Cu原子的空间利用率是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,用水吸收SO2气体时,溶液中水的电离平衡________移动(填“向左”“向右”或“不”);若得到pH=4的H2SO3溶液,试计算溶液中![]() =________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
=________;SO2可用足量小苏打溶液吸收,反应的离子方程式是_________。(已知该温度下,H2SO3的电离常数:Ka1=4.5×10-2,Ka2=2.5×10-7,H2CO3的电离常数:Ka1=8.4×10-7,Ka2=1.2×10-10)
查看答案和解析>>
科目: 来源: 题型:
【题目】用CoCO3为原料采用微波水热法和常规水热法均可制得H2O2分解的高效催化剂CoxNi(1-x)Fe2O4(其中Co、Ni均为+2价)。如图是用两种不同方法制得的CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。下列说法不正确的是( )
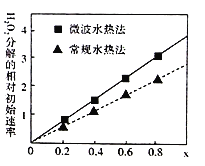
A.由图中信息,可知常规水热法制取的催化剂活性更高,Co2+的催化效果更好
B.微波协同CuO有利于H2O2除去氨态氮。该条件下,1molH2O2将NH3氧化为N2转移电子为2mol
C.常温下0.1moL/L氨水溶液的pH=a,将溶液稀释到原体积的10倍,不能使溶液pH=(a-1)
D.已知煅烧CoCO3时,温度不同,产物不同。在400℃充分煅烧CoCO3,得到固体氧化物的质量2.41g,CO2的体积为0.672L(标况下),则此时所得固体氧化物的化学式为Co3O4
查看答案和解析>>
科目: 来源: 题型:
【题目】城市地下潮湿的土壤中常埋有纵横交错的管道和输电线路,当有电流泄漏并与金属管道形成回路时,就会引起金属管道的腐蚀。原理如图所示,但若电压等条件适宜,钢铁管道也可能减缓腐蚀,此现象被称为“阳极保护”。下列有关说法正确的是( )

A.该装置能够将化学能转化为电能
B.管道右端腐蚀比左端快,右端电极反应式为Fe-2e-═Fe2+
C.如果没有外加电源,潮湿的土壤中的钢铁管道比较容易发生析氢腐蚀
D.钢铁“阳极保护“的实质是在阳极金属表面形成一层耐腐蚀的钝化膜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com