
科目: 来源: 题型:
【题目】欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
小组 | 乙烯的制备 | 试剂X | 试剂Y |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
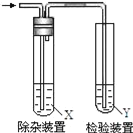
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图所示:

关于咖啡鞣酸的下列叙述正确的是( )
A.分子式为C16H13O9
B.1 mol咖啡鞣酸可与含8 mol NaOH的溶液反应
C.能使酸性KMnO4溶液褪色,说明分子结构中含有碳碳双键
D.与浓溴水能发生两种类型的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】芳香化合物A(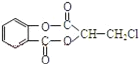 )在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如图所示的转化(其他产物和水已略去)。
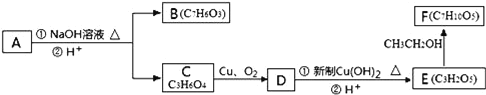
请回答下列问题:
(1)请写出A中包含的官能团的名称:__。
(2)有机物C可以由乳酸经过几步有机反应制得,其中最佳的次序是__。
A.消去、加成、水解、酸化 B.氧化、加成、水解、酸化
C.取代、水解、氧化、酸化 D.消去、加成、水解、氧化
(3)写出由E制得F的化学方程式:__。
(4)1molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠__mol,写出该反应的化学方程式:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1molH—H键断裂的同时断裂2molH—O键
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下的恒容密闭容器中,发生反应如下:X(g) + 2Y(g)![]() W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
A.Y的物质的量浓度
B.混合气体的密度
C.混合气体的压强
D.混合气体的平均相对分子量
查看答案和解析>>
科目: 来源: 题型:
【题目】难溶性杂卤石(K2SO4MgSO42CaSO42H2O)属于“呆矿”,在水中存在如下平衡
K2SO4MgSO42CaSO42H2O(s)2Ca2++2K++Mg2++4![]() +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如图1:
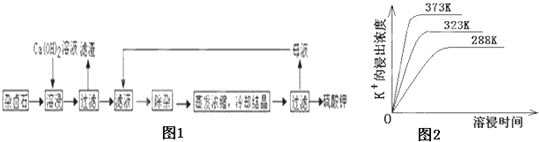
(1)滤渣主要成分有__________和___________以及未溶杂卤石.
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_______________.
(3)“除杂”环节中,先加入_______溶液,经搅拌等操作后,过滤,再加入________溶液调滤液PH至中性.
(4)不同温度下,K+的浸出浓度与溶浸时间的关系是图2,由图可得,随着温度升高,①__________________________②______________________________;
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+![]() CaCO3(s)+
CaCO3(s)+![]()
已知298K时,Ksp(CaCO3)=2.80×10﹣9,Ksp(CaSO4)=4.90×10﹣5,求此温度下该反应的平衡常数K_____________(计算结果保留三位有效数字).
查看答案和解析>>
科目: 来源: 题型:
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
己知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________:
(2)过程I 加入铁屑的主要作用是___________,分离得到固体的主要成分是______,从固体中分离出铜需采用的方法是___________________;
(3)过程II中发生反应的化学方程式为_________________________;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________。(列式计算)
查看答案和解析>>
科目: 来源: 题型:
【题目】有一烃A,能发生如图所示的一系列转化:
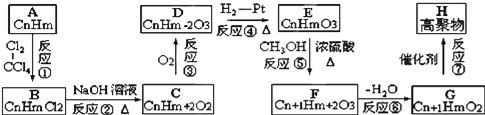
已知两个E分子间可发生缩合反应生成环状化合物C6H8O4,试解答下列问题:
(1)写出A和E的结构简式__、__。
(2)在反应①﹣⑦属于取代反应的有__。
(3)写出下列反应的化学方程式:
反应①__。
反应④__。
反应⑦__。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4溶液25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入几滴酚酞做指示剂
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管,调整液面,记下开始读数
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
滴定操作的正确顺序是(用序号填写)_______________。
(2)在D操作中应该调整液面到_________________,并使尖嘴处_____________。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是__________________。
(4)滴定到终点时锥形瓶内溶液的pH约为________;终点时颜色变化是____________。
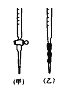
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入____(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值___________(选填“偏大”“偏小”或“无影响”)。
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com