
科目: 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过以下反应制得:2NO(g)+Cl2(g)![]() 2ClNO(g)。按投料比[n(NO):n(Cl2)]=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率 与温度T、压强p(总压)的关系如图所示:
2ClNO(g)。按投料比[n(NO):n(Cl2)]=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率 与温度T、压强p(总压)的关系如图所示:
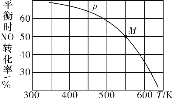
(1)该反应的△H____(填“>”“<”或“=”)0。
(2)在压强为p条件下,M点时容器内NO的体积分数为_______。
(3)若反应一直保持在p=b Pa压强条件下进行,则M点的分压平衡常数Kp=________(用含b的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(4)实验测得,v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol Cl2和1 mol NO,在一定温度下达到平衡时,NO的转化率为40%,则k正:k逆=________。(保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能源是最具应用前景的能源之一,高纯氢的制备时目前的研究热点。某工艺利用电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2.下列有关描述不合理的是
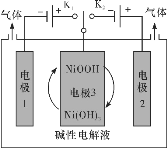
A.制H2时,产生H2的电极反应式:2H2O+2e-=H2↑+2OH-
B.制O2时,电极3要连接K2
C.若没有电极3,K1和K2直接相连,一样可以得到H2和O2
D.上述过程,若用酸性电解质一样可以实现上述过程
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________。当消耗标况下22.4升富氧空气时,有________mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g)![]() 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____(填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业炼铁用一氧化碳还原氧化铁时会发生如下一系列反应:
3Fe2O3+CO=2Fe3O4+CO2 Fe3O4+CO=3FeO+CO2 FeO+CO=Fe+CO2
某次实验中,用CO还原4.80g氧化铁,当固体质量变成4.56g时,测得此固体中只存在2种氧化物。则此固体成分和它们的物质的量之比可能的是
A.n(FeO):n(Fe3O4)=1∶1B.n(Fe2O3):n(FeO)=2∶1
C.n(Fe2O3):n(FeO)=1∶2D.n(Fe2O3):n(Fe3O4)=1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】柔性屏手机开始崭露头脚。某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收ZnSO4溶液的有机高聚物为固态电解质,其电池总反应为:MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4 ![]() MnOOH+
MnOOH+![]() ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,正确的是
ZnSO4·3Zn(OH)2·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。下列说法中,正确的是

A.充电时,含有锌膜的碳纳米管纤维一端连接电源正极
B.放电时,电极的正极反应为:MnO2+e-+H+=MnOOH
C.充电时,Zn2+移向Zn膜
D.氢键是一种特殊的化学键,键能大于共价键,能使高聚物更稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
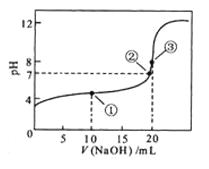
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
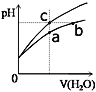
A.a、b、c三点溶液的离子浓度之和a>b>c
B.b点溶液中c(H+)+c(NH3·H2O)= c(OH-)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,恰好反应时消耗NaOH溶液的体积Vb=Vc
D.a、b、c三点溶液中水的电离程度 a>b>c
查看答案和解析>>
科目: 来源: 题型:
【题目】下列方程式书写正确的是
A.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++HSO4-
B.H2SO4溶液与NaOH溶液发生中和反应的热化学方程式为(已知H2SO4 溶液与NaOH溶液发生反应的中和热为57.3 kJ/mol):H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq) △H=-57.3kJ/mol
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的沉淀溶解平衡方程式:CaCO3(s)=Ca2+(aq)+CO32-(aq)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知重铬酸钾(K2Cr2O7)具有强氧化性,其还原产物Cr3+在水溶液中呈绿色或蓝绿色。在K2Cr2O7溶液中存在下列平衡:Cr2O72- (橙色)+H2O![]() 2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
2CrO42- (黄色)+2H+。用K2Cr2O7溶液进行实验,结合实验,下列说法正确的是
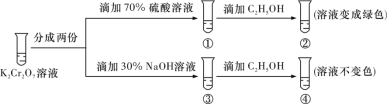
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O72-被C2H5OH氧化
C.对比②和④可知K2Cr2O7碱性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
查看答案和解析>>
科目: 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间的变化关系如图所示。下列说法中正确的是
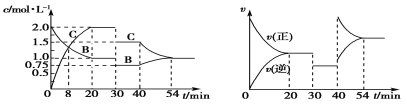
A.反应方程式中的x=1
B.该反应为放热反应
C.30 min时改变的条件是加入催化剂
D.前30 min内 A的反应速率为0.05 mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com