
科目: 来源: 题型:
【题目】将一定的![]() 、
、![]() 合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中
合金置于水中,结果合金完全溶解,得到20mL、pH=14的溶液,然后用1mol/L的盐酸滴定至沉淀最大时,消耗40mL盐酸。原合金中![]() 的物质的量( )
的物质的量( )
A.0.01molB.0.02molC.0.03molD.0.04mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为( )
A.920 kJB.557 kJC.188 kJD.436 kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃、101kPa下,碳、氢气、甲烷和辛烷的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、5518kJ/mol,则下列热化学方程式书写正确的是( )
A.C(s)+![]() O2(g)=CO(g) ΔH=-393.5kJ/mol
O2(g)=CO(g) ΔH=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(l) ΔH=+571.6kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
D.C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol
O2(g)=8CO2(g)+9H2O(l) ΔH=-5518kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.含0.1molFeI2的溶液中通入0.125molCl2:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
B.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+![]() Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
C.Cu溶于稀HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O
D.氢氧化铁中加入过量氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在2A+B![]() 3C+4D反应中,表示该反应速率最快的是( )
3C+4D反应中,表示该反应速率最快的是( )
A.v(A)=0.4mol/(L·s)
B.v(B)=0.3mol/(L·s)
C.v(C)=0.3mol/(L·s)
D.v(D)=2mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
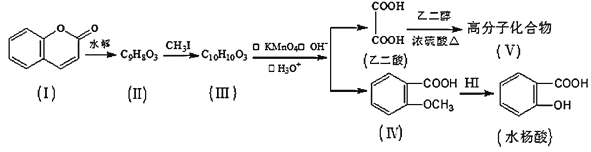
【题目】香豆素(结构如图中I所示)是用途广泛的香料,由香豆素经下列图示的步骤可转变为水杨酸。
已知:CH3CH=CHCH2CH3![]() CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH
请回答下列问题:
(1)香豆素分子中的官能团的名称为__,步骤Ⅱ→Ⅲ的反应类型为__。
(2)有机物III的结构简式为__,在上述转化过程中,设计反应步骤II→III的目的是__。
(3)下列关于有机物Ⅰ、Ⅱ、Ⅲ、Ⅳ的叙述中正确的是__(选填序号)。
A.可用FeCl3溶液来鉴别II和III
B.Ⅳ中核磁共振氢谱共有4种峰
C.Ⅰ、Ⅱ、Ⅲ均可使溴的四氯化碳溶液褪色
D.1molⅡ最多能和2molNaHCO3发生反应
(4)香豆素在过量NaOH溶液中完全水解的化学方程式为__。
(5)写出乙二酸和乙二醇(HOCH2CH2OH)生成Ⅴ的化学方程式为__。
(6)化合物Ⅳ有多种同分异构体,符合下列两个条件的芳香族同分异构体共有__种。
①遇FeCl3溶液发生显色反应;
②能发生水解反应和银镜反应。
其中,核磁共振氢谱共有5种吸收峰,且吸收峰面积比为1∶2∶2∶2∶1同分异构体的结构简式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)广泛用于电镀、鞣制皮革、棉织品漂白后的脱氯剂等。某实验小组的同学以Na2S和SO2为原料制备Na2S2O3。回答下列问题:
(1)制备Na2S溶液:
①Na2S溶液呈碱性,原因是___(用离子方程式表示)。
②工业品硫化钠中常含有少量Na2SO4和Na2CO3,需进行纯化,将工业品硫化钠溶于水,然后加入适量的___(填化学式)溶液充分搅拌并过滤,再精制得Na2S溶液。
(2)利用如图装置制备Na2S2O3:
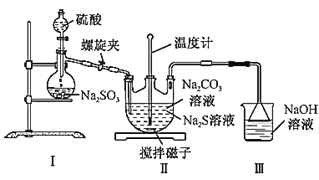
①盛放硫酸的实验仪器的名称是___。
②装置Ⅰ中反应的化学方程式为___。
③三颈烧瓶内生成Na2S2O3的化学方程式为___;装置Ⅲ的作用是___。
查看答案和解析>>
科目: 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
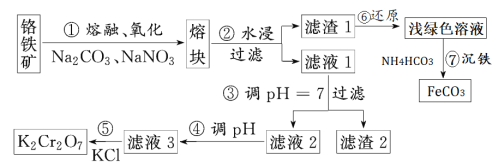
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3→Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后NaNO3与FeO·Cr2O3与的系数比为___。该步骤不能使用陶瓷容器,原因是___。
(2)滤渣1中主要成分是___,滤渣2中含量最多的金属元素名称是___。
(3)步骤④调滤液2的pH变小的目的是___(用离子方程式表示)。
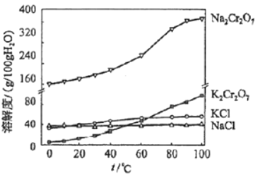
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,___、___,过滤得到K2Cr2O7固体。该反应的反应类型是___。
(5)写出步骤7中涉及的离子方程式___。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成气经压缩升温后进入10m3的甲醇合成塔中,在催化剂的作用下进行甲醇合成,主要反应是:2H2(g) + CO(g)![]() CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
CH3OH(g)+181.6kJ。已知:某温度下(设温度为T1℃)此反应的平衡常数为160。
(1)此温度下,在密闭容器中加入一定量的CO和H2,反应到某时刻测得各组分的浓度如表:
物质 | H2 | CO | CH3OH |
浓度/(mol/L) | 0.2 | 0.1 | 0.4 |
比较此时正、逆反应速率的大小:v正_______v逆 (填“>”、“<”或“=”);若加入与上述同样多的CO和H2,在T2℃条件下反应,10 min后达平衡时c(H2)=0.4mol/L,则该时间内反应速率v(CH3OH)=_______ mol/(L·min);
(2)在一定条件的密闭恒容的容器中,下列式子或文字描述能表示上述反应达到化学平衡状态的是_______(选填序号);
a.2v逆(CO) = v正(H2)
b.c(CO): c(H2):c(CH3OH) =1:2:1
c.混合气体的平均式量保持不变
d.混合气体的密度保持不变
(3)上述反应达到平衡后,下列说法正确的是_______(选填序号);
a.其他条件不变,增大压强,平衡常数K﹤160
b.其他条件不变,温度升高,平衡常数K会减小
c.其他条件不变,若同比例地增加CO和H2的量平衡不会发生移动
d.其他条件不变,增大甲醇的物质的量,正反应速率也会随之逐渐增大
(4)寻找合适的催化剂来改善上述合成甲醇的条件一直是研究课题。现分别对X、Y、Z三种催化剂进行如下实验(其他条件均相同):
①X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂并简述理由____。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢铁“发蓝”是在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。完成下列填空:
(1)其技术过程中有如下的化学方程式:
①____Fe+____NaNO2+____NaOH—____Na2FeO2+____H2O+____NH3↑;
②6Na2FeO2 + NaNO2 + 5H2O =3Na2Fe2O4 + NH3↑ + 7NaOH;
③Na2FeO2 + Na2Fe2O4 + 2 H2O = Fe3O4 + 4 NaOH;
试配平方程式①,并标出电子转移的方向和数目_____________。
(2)在讨论上述三个反应时,甲、乙、丙三位同学各自提出了他们的看法,其中说法正确的是_____________。
甲同学:该生产过程中不会产生污染问题
乙同学:只要是有NaNO2 参与的反应,它都是充当氧化剂角色的
丙同学:每一步过程中涉及到的化学反应都可归属于氧化还原反应原理
(3)若整个过程共获得67.2升氨气(标况下)则电子转移________mol。
(4)若获得1mol Fe3O4,则反应过程中NaOH的量将多________(填“消耗”或“产出”)________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com