
科目: 来源: 题型:
【题目】![]() 是一种杀菌效率高、二次污染小的水处理剂。实验室可通过反应制得
是一种杀菌效率高、二次污染小的水处理剂。实验室可通过反应制得![]() :
:![]() 。下列说法正确的是
。下列说法正确的是
A.氧化产物为![]() B.
B.![]() 在反应中失去电子
在反应中失去电子
C.氧化剂与还原剂的物质的量之比为1∶2D.1mol![]() 参加反应有2mol电子转移
参加反应有2mol电子转移
查看答案和解析>>
科目: 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A.在Al3+数目为NA的AlCl3溶液中,Cl-总数为3 NA
B.常温下,42g乙烯和丙烯的混合物中所含H原子的数目是6 NA
C.4molNH3与6molO2在催化剂和加热条件下充分反应,所得产物中NO的分子数是4 NA
D.常温常压下,2g羟基(![]() )中所含的中子数为NA
)中所含的中子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物H是一种药物合成中间体,其合成路线如下:
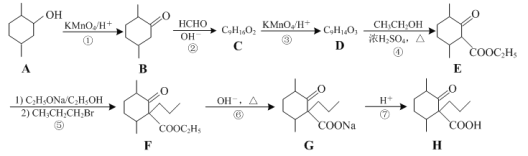
(1)A→B的反应的类型是____________反应。
(2)化合物H中所含官能团的名称是____________和____________。
(3)化合物C的结构简式为___________。B→C反应时会生成一种与C互为同分异构体的副产物,该副产物的结构简式为___________。
(4)D的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:____________。
①能发生水解反应,所得两种水解产物均含有3种化学环境不同的氢;
②分子中含有六元环,能使溴的四氯化碳溶液褪色。
(5)已知:![]() CH3CH2OH。写出以环氧乙烷(
CH3CH2OH。写出以环氧乙烷(![]() )、
)、![]() 、乙醇和乙醇钠为原料制备
、乙醇和乙醇钠为原料制备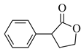 的合成路线流程图_______________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______________(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如图装置(夹持装置略)制备高效水处理剂高铁酸钾(K2FeO4)并探究其性质。
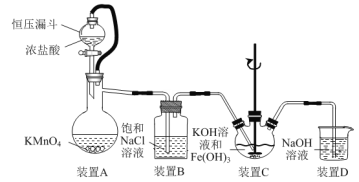
已知K2FeO4具有下列性质:①可溶于水,微溶于浓KOH溶液;②在0℃~5℃、强碱性溶液中比较稳定,在Fe(OH)3或Fe3+催化下发生分解;③在弱碱性至酸性条件下,能与水反应生成O2和Fe(OH)3(或Fe3+)。
(1)装置A用于制取氯气,其中使用恒压漏斗的原因是____。
(2)为防止装置C中K2FeO4分解,可以采取的措施是____和____。
(3)装置C中生成K2FeO4反应的离子方程式为____。
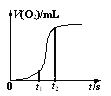
(4)用一定量的K2FeO4处理饮用水,测得产生O2的体积随时间的变化曲线如图所示。t1 s~t2 s内,O2的体积迅速增大的主要原因是____。
(5)验证酸性条件下氧化性FeO42->Cl2的实验方案为:取少量K2FeO4固体于试管中,____。(实验中须使用的的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)
(6)根据K2FeO4的制备实验得出:氧化性Cl2>FeO42-,而第(5)小题实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是
A.铝制容器不宜长时间存放酸性食物、碱性食物以及含盐腌制食物
B.生活中常用热的小苏打除油污,利用的是水解反应吸热的特点
C.![]() 可通过电解
可通过电解![]() 的水溶液来制取,
的水溶液来制取,![]() 可通过电解熔融的
可通过电解熔融的![]() 来制取
来制取
D.用浓硫酸刻蚀石英材料制作艺术品
查看答案和解析>>
科目: 来源: 题型:
【题目】I、有一种金属单质A,焰色反应呈黄色,能发生下图所示的变化:
![]()
上图中淡黄色固体B是__________;其与H2O反应的化学方程式为__________________。写出上图中的C溶液与硝酸溶液反应的化学方程式_____________________。
II、下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。 请根据要求回答问题:

(1)②的元素符号是__________;该元素的最高价氧化物的电子式为__________;
(2)⑤和⑥两种元素的非金属性强弱关系是:⑤________⑥(填“>”或“<”);
(3)①和③两种元素组成的化合物中含有的化学键为__________(填“离子键”或“共价键”)
(4)④和⑥两种元素组成的化合物与AgNO3溶液反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】研究汽车尾气的产生、转化对环境保护有重要意义。汽车尾气管中的三元催化剂能同时实现CO、CxHy、NOn三种成分的净化。
(1)已知热化学方程式:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
N2(g)+O2(g)![]() 2NO(g) ΔH=+180 kJ·mol-1
2NO(g) ΔH=+180 kJ·mol-1
则反应CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) ΔH=____kJ·mol-1。
(2)研究表明,温度对CO、CxHy、NOn的产生和排放有较大影响。
①汽车发动机内的温度越高,生成的NO越多,原因是____。
②当汽车刚冷启动时,汽车尾气管排放的CO、CxHy、NOn浓度较高,一段时间后浓度逐渐降低。汽车刚冷启动时排放CO、CxHy、NOn浓度较高的原因是____。
(3)催化剂表面CO、CxHy、NOn的转化如图1所示,化合物W可借助图2 (傅里叶红外光谱图)确定。
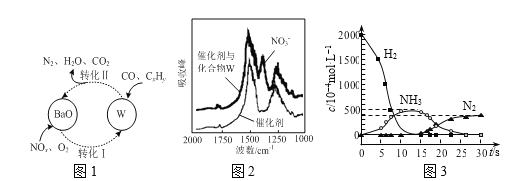
①在图1所示转化中,W的化学式为____。若转化Ⅱ中消耗CO的物质的量为1mol,生成N2的物质的量为1mol,则被CxHy还原的W的物质的量为____。
②用H2代替CO、CxHy与W反应,该过程相关物质浓度随时间的变化关系如图3所示。该过程分为两步,第一步反应消耗的H2与W的物质的量之比是____。
(4)尾气净化过程中,有时会产生N2O。用同位素示踪法研究发现N2O的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的N2O几乎都是15NNO。写出该反应的化学方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸铁铵[(NH4)xFey(SO4)znH2O]是一种重要铁盐,实验室采用废铁屑来制备硫酸铁铵的流程如下:
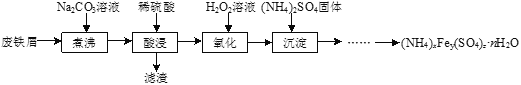
(1)将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,原理是_____________。
(2)“氧化”过程需使用足量的H2O2,同时溶液要保持pH小于0.5,目的是__________。
(3)化学兴趣小组用如下方法测定硫酸铁铵晶体的化学式:
步骤1:准确称取样品28.92 g,溶于水配成100 mL溶液。
步骤2:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入适量稀硫酸,滴加过量的SnCl2溶液(Sn2+与Fe3+反应生成Sn4+和Fe2+),充分反应后除去过量的Sn2+。用0.1000molL-1的K2Cr2O7溶液滴定Fe2+,滴定至终点时消耗K2Cr2O7溶液25.00 mL。(滴定过程中Cr2O72-转化成Cr3+)
步骤3:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入过量的BaCl2溶液,将所得白色沉淀过滤、洗涤、干燥后称量,所得固体质量为6.99 g。
①排除装有K2Cr2O7溶液的滴定管尖嘴处气泡的方法是_________。
②通过计算确定该硫酸铁铵的化学式____________(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学学习小组利用如图装置来制取乙酸乙酯。
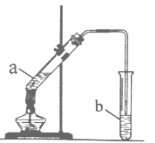
I.实验过程:向试管a中加入碎瓷片,3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸,最后加入2mL乙酸,按图连接好装置,用酒精灯缓慢加热,将产生的蒸汽经导管通到b试管中的液面上。
II. 已知化学方程式:CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
III.查阅资料得知:乙酸乙酯不溶于水,密度比水小,且有香味
请回答下列问题:
(1)试管a中加入碎瓷片,其作用是_____(填字母代号)。
A.加快化学反应速率 B.防止溶液暴沸
(2)试管b中的溶液是_____(填字母代号)。
A饱和碳酸钠溶液 B.饱和氢氧化钠溶液
(3)实验完毕后,将b试管中的液体充分振荡,静置后,溶液分为两层。
①乙酸乙酯在________(填“上层”或“下层”)。
②常用________操作将两层液体分离(填“过滤”或“分液”)。
(4)实验中加入乙酸的质量为2.1g,其中60%的乙酸发生酯化反应,则得到乙酸乙酯的质量为______g(计算结果保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.1mol·L-1的KOH溶液滴定10mL0.1mol·L-1的H2C2O4溶液,所得滴定曲线如图所示。忽略混合时溶液体积的变化,下列有关各点溶液中粒子浓度关系正确的是
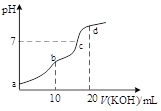
A.a点溶液中:c(H+)=0.1mol·L-1+c(OH-)-c(H2C2O4)+c(C2O42-)
B.b点溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.c点溶液中:c(K+)<c(C2O42-)-c(H2C2O4)+0.1mol·L-1
D.d点溶液中:c(OH-)-c(H+)=c(H2C2O4)+c(HC2O4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com