
科目: 来源: 题型:
【题目】金属钼(Mo)常用于工业、军事等领域,已被多个国家列为战略金属,我国的钼储量居世界第二。回答下列问题
(1)Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________。
(2)辉钼(MoS2)在纳米电子设备制造领域比硅或富勒烯(如C60)更有优势,可用H2S硫化(NH4)2MoO4溶液生产辉钼。H2S分子VSEPR模型为____________,(NH4)2MoO4中所有元素的第一电离能由大到小的顺序为________________;MoS2纳米粒子具有类似于石墨的层状结构,具有优异的润滑性能,其原因是___________________________。
(3)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2+4H2+2Na2CO3![]() Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号
Mo+2CO+4H2O+2Na2S,分子或离子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则碳酸钠中CO32-离子中的大π键应表示为________。
),则碳酸钠中CO32-离子中的大π键应表示为________。
(4)钼的一种配合物化学式为:Na3[Mo(CN)8]8H2O,其中除共价键、配位键以外还存在的作用力有_____________,其中配体离子中σ键与π键数目之比为_________。
(5)金属钼晶体中的原子堆积方式如图所示,这种堆积方式为_________堆积。若晶体钼的密度为ρg·cm-3,钼原子半径为r pm,NA表示阿伏加德罗常数的值,M表示钼的相对原子质量,则钼晶胞中原子的空间利用率为__________________(用含有ρ、r、NA、M的代数式表示)。

查看答案和解析>>
科目: 来源: 题型:
【题目】美国马丁·卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖。他们模拟出了1, 6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示。下列说法正确的是 ( )
![]()
A. 该有机物属于芳香烃,与苯互为同系物
B. 该有机物的分子式为C18H18
C. 1 mol该有机物在常温下最多能与9 mol Br2发生加成反应
D. 该有机物可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】标准状况下,将一块铁溶于800mL1mol/L的稀硫酸溶液中,反应完全,求:
(1)所溶解铁的质量为多少____?
(2)产生的H2的体积为多少____?
(3)完全反应后,硫酸亚铁的浓度是多少____?
查看答案和解析>>
科目: 来源: 题型:
【题目】钼及其合金在冶金、环保和航天等方面有着广泛的应用。
(1)Mo可被发烟硝酸及氢氟酸氧化为MoO2F2和MoOF4(少量),硝酸本身被还原为NO2,则该反应中氧化剂与还原剂的物质的量之比为_________。
(2)已知:2Mo(s)+3O2(g)=2MoO3(s) △H1;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H2;
MoS2(s)+2 O2(g)=Mo(s)+2SO2(g) △H3
则△H3=_________(用含△H1、△H2的代数式表示)
(3)电氧化法提纯钼的原理:将辉钼矿(MoS2)放入装有食盐水的电解槽中,用惰性电极电解,MoS2被氧化为MoO42-和SO42-
①辉钼矿应放入电解槽的_________(填“阴极区”或“阳极区”)。
②阴极的电极反应式为___________________________。
(4)碳酸钠作固硫剂并用氢还原辉钼矿的原理为MoS2(s)+4H2(g)+2Na2CO3(s) ![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,实验测得平衡时的有关变化曲线如图所示。
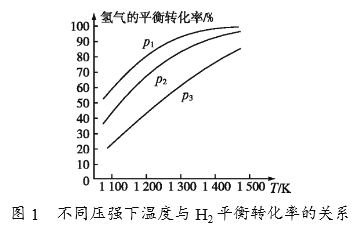
①由图1可知,该反应△H______(填“>”或“<”)0,p1、p2、p3由大到小的顺序为_______________________。
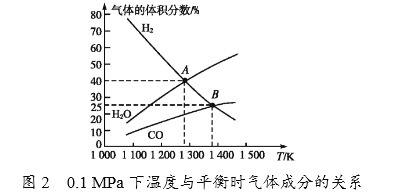
②由图2可知,A点时H2的平衡转化率为____________。
③B点对应的平衡常数K=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)(MPa)2。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ni常被镀在金属制品上以保护金属不生锈。
(1)镀镍的方法有:方法Ⅰ: 电镀镍。以NiSO4为电镀液。
①待镀零件与电源___________相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)____Ni2++____H2PO2-+_____→___Ni ++______H2PO3-+____,
(b)6H2PO2-+ 2H+= 2P+ 4H2PO3-+ 3H2↑![]()
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
②写出并配平反应式(a)。______________
(2)LiNiO2是一种前景很好的锂离子电池正极材料。当温度高于850℃时,LiNiO2会分解。工业上用Ni(OH)2与LiOH的混合物在空气流中加热到700~800℃制得 LiNiO2,该反应的化学方程式为________________,加热温度不宜过高的原因是________________________,工业上也可用LiNO3代替上述工艺中的LiOH,存在的缺点可能是____________。
(3)以废旧二次电池为原料回收利用合成Ni(OH)2的工艺:
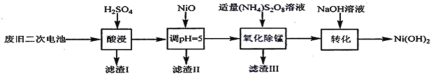
已知:酸浸后滤液中含有Ni2+、Al3+、Fe3+、Mn2+;Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.0×10-33,Ksp[Ni(OH)2]=1.6×10-14;
①“氧化除锰”是将锰元素最终转化为MnO2而除去,反应历程如下:
i.5S2O82-+2Mn2++8H2O=2MnO4-+10SO42-+16H+;
ii._____________________________________(用离子方程式表示)。
②调pH=5操作时,已知溶液中Ni2+浓度为2.0mol/L,则“滤渣II”中是否存在Ni(OH)2沉淀?____________(列式计算,并使用必要的文字说明)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数![]() (X)=
(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:

下列说法正确的是
A. 反应HCO3-![]() H++CO32-的lgK=-6.4
H++CO32-的lgK=-6.4
B. pH═8的溶液中:c(Na+)>c(HCO3-)
C. NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)═c(Cl-)
D. 向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO3-+OH-═CO32-+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.往碘化亚铁中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸银溶液中加入过量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列五种有机物中:A.CH4;B.CH2=CH2;C.CH3CH2OH;D.CH3COOH;E.淀粉。
(1)C分子中含有的官能团的名称是_____;
(2)A分子的结构式是_____;
(3)水溶液显酸性的是_____(填编号);
(4)可用于合成聚乙烯塑料的是_____(填编号),化学反应方程式为_____________________ ;
(5)通常用于检验碘单质的是_____(填编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】1,3—二异丙烯基苯![]() 是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
是重要的化工原料。下列有关1,3一二异丙烯基苯的说法正确的是
A.可以发生加成聚合反应B.不能使稀高锰酸钾溶液褪色
C.分子中所有原子共平面D.其苯环上的二氯代物有3种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com