
科目: 来源: 题型:
【题目】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。

I.利用装置A和C制备Sr3N2
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先将___________,然后稍稍用力即可将玻璃管插入橡皮管。
(2)写出由装置A制备N2的化学反应方程式___________。
(3)装置A中a导管的作用是________。利用该套装置时,有同学提出应先点燃置A的酒精灯一段时间后,再点燃装置C的酒精灯,你同意其观点吗?_______(“同意”或“不同意”)。理由是___________。
Ⅱ.利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(4)写出装置B的NaOH溶液中发生反应的离子方程式___________。
(5)装置C中广口瓶盛放的试剂是___________。
Ⅲ.测定Sr3N2产品的纯度
(6)取10.0g该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是_______。经改进后测得浓硫酸增重1.02g,则产品的纯度为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列与处理方法对应的反应方程式不正确的是
A.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
B.用高温催化氧化法去除烃类废气(CxHy):CxHy+(x+y/4)O2![]() xCO2+y/2H2O
xCO2+y/2H2O
C.用催化法处理汽车尾气中的CO和NO:CO+NO![]() C+NO2
C+NO2
D.用Na2S形成沉淀去除废水中的Hg2+:Hg2++S2-=HgS↓
查看答案和解析>>
科目: 来源: 题型:
【题目】垃圾的分类收集是实现垃圾处理无害化、减量化和资源化的重要措施。向贴有如下图所示标志的垃圾箱中丢弃的垃圾应是

A.厨房垃圾B.可回收垃圾C.有害垃圾D.其他垃圾
查看答案和解析>>
科目: 来源: 题型:
【题目】药物瑞德西韦对新型冠状病毒(COVID-19)有明显抑制作用。K是合成瑞德西韦的关键中间体,其合成路线如下:
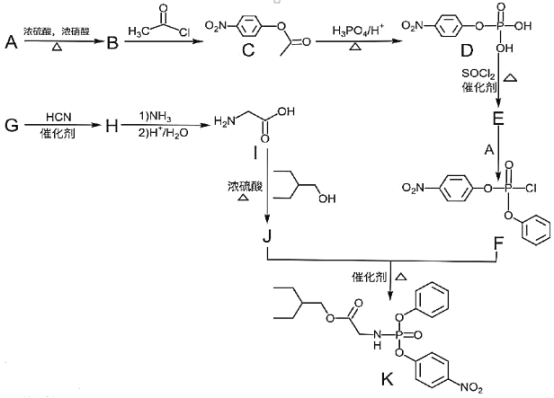
①R-OH![]() R-Cl;
R-Cl;
②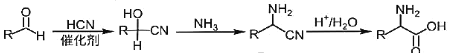
回答下列问题:
(1)B的结构简式为_________________________,B→C的反应类型为_____________,J中含氧官能团的名称为_______________,G→H的反应化学方程式为_____________________________________________。
(2)写出符合下列条件的C的同分异构体X__________________________(填结构简式,不考虑立体异构)。
①苯环上含有硝基且苯环上只有一种氢原子; ②与FeCl3溶液发生显色反应; ③1molX与足量金属Na反应可生成2g H2 。
(3)E中含两个Cl原子,则E的结构简式为________________________________________________。
(4)写出以苯甲醇为原料制备 的合成路线(其它试剂任选):________________。
的合成路线(其它试剂任选):________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为________________________。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,Te属于元素周期表中______区元素,其基态原子的价电子排布式为______________________。
(3)CO32-的空间构型为___________________,碳酸丙烯酯的结构简式如图所示,
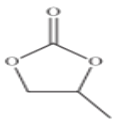
其中碳原子的杂化轨道类型为____________,1mol碳酸丙烯酯中σ键的数目为_________________。
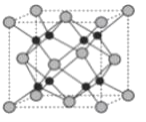
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为____________,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为____________cm(用含有ρ、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是用途最广的金属材料之一。为探究铁的化学性质,某同学将盛有铁屑的试管塞上蓬松的棉花,然后倒置在水中(如右图所示)。数天后,他观察到的现象是( )。
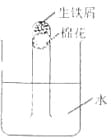
A.铁屑不生锈,试管内液面上升
B.铁屑不生锈,试管内液面高度不变
C.铁屑生锈,试管内液面上升
D.铁屑生锈,试管内液面高度不变
查看答案和解析>>
科目: 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的![]() ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A、B、C三种元素的第一电离能由小到大的顺序为____________ (用元素符号表示);A、B、C三种元素的简单氢化物的稳定性顺序为:_______(用化学式表示)。
(2)D元素原子的价电子排布式是________,估计D元素的第2次电离能飞跃数据将发生在失去第______个电子时。
(3)C元素的电子排布图为______。E的外围电子排布为_______ ,E原子的结构示意图为_______。
(4)F元素位于元素周期表的_______区,其基态原子的电子排布式为________。
(5)G元素可能的性质________。
A 其单质可作为半导体材料 B 其电负性大于磷
C 其原子半径大于锗 D 其第一电离能小于硒
(6)电离能比较:I1(Mg)________I1(Al)(填“>”或“<”),其原因______。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛(HCHO)俗称蚁醛,是一种重要的化工原料。可通过以下方法将甲醇转化为甲醛。
脱氢法:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09 kJ·mol-1
氧化法:CH3OH(g)+![]() O2(g)=HCHO(g)+H2O(g)ΔH2
O2(g)=HCHO(g)+H2O(g)ΔH2
回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g)ΔH3=-483.64 kJ·mol-1,则ΔH2=_________________。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因为________________________________________。
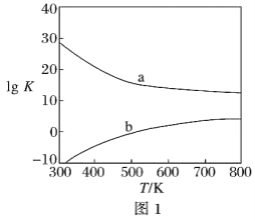
(3)图1为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。曲线_____(填“a”或“b”)对应脱氢法,判断依据是_____________________________________。
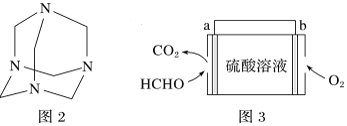
(4)将甲醛水溶液与氨水混合蒸发可制得乌洛托品(结构简式如图2),该物质在医药等工业中有广泛用途。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为___________。
(5)室内甲醛超标会危害人体健康,通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图3所示,则a极的电极反应式为_________________________________________________,当电路中转移4×10-4 mol电子时,传感器内参加反应的HCHO为________________mg。
查看答案和解析>>
科目: 来源: 题型:
【题目】以物质的量为中心的相关计算,已知阿伏加德罗常数为NA。
(1)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(2)73.0g HCl气体中含有_______个分子、______个质子。
(3)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为______, M的相对原子质量为________。
(4)将0.5L1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是_____。
(5)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(6)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
查看答案和解析>>
科目: 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率= ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
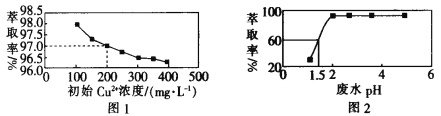
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com