5-
5-羧基荧光素(5-FAM)
5-羧基二乙酸荧光素(5-CFDA)
试题详情
下列说法不正确的是
(
) 学科网 学科网 学科网 学科网 试题详情
 A.5-FAM转变为5-CFDA属于取代反应
B.5-FAM的分子式为:C21H12O7 A.5-FAM转变为5-CFDA属于取代反应
B.5-FAM的分子式为:C21H12O7
试题详情
试题详情
试题详情
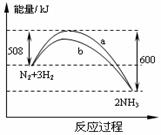 12、在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是 12、在一定温度时,N2与H2反应过程中能量变化的曲线如右图。下列叙述正确的是
A.加入催化剂,该化学反应的放热增多 B.b曲线是加入催化剂时的能量变化曲线 C.加入催化剂可增大正反应速率,降低逆反应速率 试题详情
D.该反应的热化学方程式为:N2+3H2 2NH3 △H=-92kJ/moL 2NH3 △H=-92kJ/moL 试题详情
13、下列比较中,正确的是 A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF> NaCN B.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:2c (Na+) = c (S2?) +c (HS?)+ c
(H2S) 试题详情
C.0.2 mol•L-l NH4Cl
和 0.l mol•L-l NaOH 溶液等体积混合后: c (NH4+) > c (Cl?) > c (Na+) > c (OH-) > c (H+) 试题详情
D.将①0.01mol/L的CH3COOH溶液、②0.01mol/L的盐酸、③pH=12的氨水、④pH=12 的NaOH溶液稀释相同倍数后溶液的pH:③>④>①>② 试题详情
14.常温下,向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同物质的量的氯化钠粉末,不断搅拌,实验时分别记录反应过程中0-15min时温度升高的幅度(参见下图),下列说法错误的是 试题详情
试题详情
A.NaCl的用量不必大于0.125mol原因是再加入NaCl反而会降低反应速率 试题详情
B.如果在实验中加入了0.060molNaCl,则第15min时混合物的温度接近于42℃ C.铁粉、NaCl能使反应速率增加,原因是镁粉、铁粉与NaCl的水溶液构成了原电池 试题详情
D.在其它条件不变下,如果把0.10mol镁粉改成等量的镁条,当加入0.075molNaCl时,纵坐标数值会小于50 非 选 择 题 试题详情
15、氮的氧化物(用NOx表示)是大气污染物,必须加以处理。 (1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循 环的无毒气体。反应化学方程式可表示为:
。 (2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质。某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程。 试题详情
 提供的装置: 提供的装置:
NH3的制取 ①所提供的装置中能快速、简便制取NH3的装置是: (填仪器序号)。 ②若采用C装置制取氨气(控制实验条件相同),情况如下表: 试剂组合序号 固体试剂(g) NH3体积(mL) a 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
10.8g (NH4)2SO4 3584 分析表中数据,实验室制NH3产率最高的是: (填序号),其它组合NH3产率不高的原因是:
。 试题详情
 模拟尾气的处理 模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置: ①A中反应的离子方程式:
。 ②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是: 。 ③D装置中的液体可换成
(填序号)。 a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4 ④该同学所设计的模拟尾气处理实验还存在的明显缺陷是:
。 试题详情
16.(8分)已知下图中A为单质,D为气体,E和H均为白色沉淀,其中H不溶于稀硝酸,反应中的水和部分产物已略去。根据框图回答问题: 试题详情
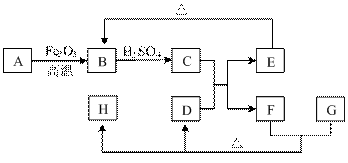
⑴D的化学式为___________。 ⑵写出“A→B”发生反应的化学方程式 _________________________________________________。 ⑶若在C的溶液中逐滴滴加G溶液,生成的沉淀先增多,后减少,分别写出上述过程中发生反应的离子方程式 __________________________、____________________________。 试题详情
17、一工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料): 已知① A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。 ② IV中的电解反应式为MnSO4+ZnSO4+2H2OMnO2+
Zn+2H2SO4。 (1)A中属于还原产物的是___________。 试题详情
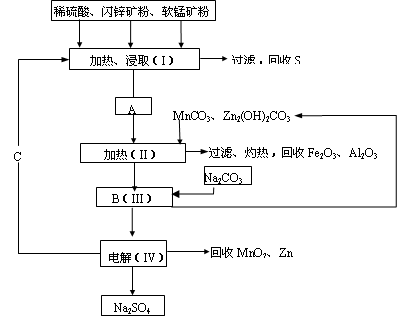 (2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。 (2)MnCO3、Zn2(OH)2CO3的作用是_____________________________;II需要加热的原因是___________;C的化学式是____________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______________。 (4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是___________。 (5)要从Na2SO4溶液中得到芒硝(Na2SO4?10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。 (6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是__________。 试题详情
18、氢气是一种新型的绿色能源,又是一种重要的化工原料。 试题详情
(1) 氢气燃烧热值高。实验测得,在常温常压下,1gH2完全燃烧生成液态水,放出142.9 kJ 热量。则H2燃烧的热化学方程式为 。 试题详情
(2)氢氧燃料电池具有广阔的发展前景。右图所示的氢氧燃料电池中,电池负极的反应式是 。 试题详情
(3)氢气是合成氨的重要原料。工业上合成氨的反应是:N2(g)
+ 3H2(g) 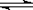 2NH3(g);ΔH= -92.2 kJ?mol-1。 2NH3(g);ΔH= -92.2 kJ?mol-1。 ①一定条件下,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中加入催化剂引起反应速率变化的时间段是 (填,如0~t1等)。 试题详情
②温度为T℃时,将2amolH 2和amolN 2放入0 . 5L密闭容器中,充分反应后测得N 2的转化率为50?。则该温度下反应的平衡常数为 (用含a的代数式表示)。
(4)工业上生产氢气是将水蒸气通过红热的炭,产生水煤气: 试题详情
C(s)
+ H2O(g)  H2(g) + CO(g) △H = +131.3 kJ/mol H2(g) + CO(g) △H = +131.3 kJ/mol 该反应在低温下不能自发进行的原因是
。 A.△H >0
B.温度较低时,△H影响为主 C.△S<0
D.温度较低时,△S影响为主 试题详情
19、肉桂酸甲酯(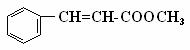 )常用于调制具有草莓、葡 )常用于调制具有草莓、葡 萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是 ; (2)有关肉桂酸甲酯的叙述中,正确的是 (填标号); A.能与溴的四氯化碳溶液发生加成反应 B.无法使酸性高锰酸钾溶液褪色 C.在碱性条件下能发生水解反应 D.不可能发生加聚反应 试题详情
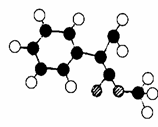 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如 (3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如
右图所示(图中球与球之间连线表示单键或双键)。G的 结构简式为 ; (4)用芳香烃A为原料合成G的路线如下:? 试题详情
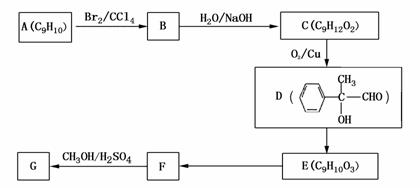 ? ?
① 化合物E中的官能团有 (填名称)。 ② F→G的反应类型是 ,该反应的化学方程式为 。 ③ 写出符合下列条件的F的同分异构体的结构简式 。 ?.分子内含苯环,且苯环上只有一个支链;? ?.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。 试题详情
20、某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将0.454g X隔绝空气在1000℃以上强热,得到一种红色固体Y,质量为0.288g。Y溶于稀硫酸得到另一种红色固体0.128g(已知铜的化合价有+1和+2价)。 (1)该实验人员认为沉淀X可能含有SO42-。请设计一个简单实验确定这一判断。 (2)Y与稀硫酸反应的离子方程式为:
。 (3)通过计算确定X的组成? (4)混合时CuSO4和NaOH溶液的体积比为
;写出X→Y的反应方程式::
。 试题详情
21.物质结构与性质12分 不锈钢是由铁、铬、镍、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素。其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀。 (1)基态碳(C)原子的轨道表示式为 。 (2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为 ;已知CrO5中Cr为+6价,则CrO5的结构式为 。 (3)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测:四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。 A.水 B.四氯化碳 C.苯 D.硫酸镍溶液 试题详情
 (4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是 。 (4)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是 。
试题详情
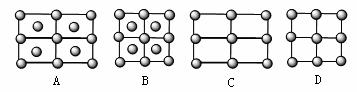
(5)据报道,只含镁、镍和碳三种元素的晶体竟然具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,试写出该晶体的化学式
。晶体中每个镁原子周围距离最近的镍原子有
个。 试题详情
|
试题详情
题号 1 2 3 4 5 6 7 8 答案 D B A C B D D D 题号 9 10 11 12 13 14 答案 B AC CD B BD AB 15、(1)2xCO + 2NOx ==== 2xCO2 +
N2 (2分), (2)步骤一、NH3的制取 ①
H(1分) ② f(1分) 因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合成NH4Cl(1分); 而用NaOH或Ca(OH)2作反应物产生的水较多,吸收的NH3较多(1分)。(意思 相近均给分) 步骤二、模拟尾气的处理 ① 3Cu + 8H+
+ 2NO3? ==
3Cu2+ + 2NO↑ + 4H2O(2分) ②
防止氨气溶解(或防止倒吸) (1分) ③ c(1分) ④未反应的NO无法处理,会污染环境(1分) 16.(8分)⑴NH3;⑵2Al+Fe2O32Fe+Al2O3; ⑶2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ Al(OH)3+OH-=AlO2-+2H2O(每空2分) 17、(1)MnSO4;(2)增大溶液的pH,使Fe3+和 Al3+生成沉淀; 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀; H2SO4;(3)Fe2O3、Al2O3、S ;(4)纯碱 、H2SO4;(5)降温结晶;(6)1.03(或1) 18、(1) H2 (g)+ 1/2 O2
(g)=H2O (l) △H = -285.8 kJ /mol (2) H2 -2 e- +2OH- =2H2O
(3)① t4~t5 ② (4)B
(每空2分,共10分 ) 19、(1)C10H10O2 (1分) (2)A、C (2分)  (3) (1分) (3) (1分)
(4)①羧基、羟基 ②酯化反应“或取代反应”,(2分,各1分)  (2分) (2分)
③  (2分) (2分) 20、(1)将绿色沉淀X用蒸馏水多次洗涤,至洗涤液中用BaCl2溶液检验不出SO42-后,用稀盐酸溶解绿色沉淀,此时再用BaCl2溶液检验,溶解液中有白色沉淀生成,则说明沉淀X中有SO42-……………………2分 (2)Cu2O+2H+=Cu+Cu2+
+H2O……………………2分 (3)因为Cu2O∶Cu=0.454∶0.128 可判断Y为Cu2O 根据硫酸铜溶液跟氢氧化钠溶液混合生成沉淀,可设沉淀组成为mCu(OH)2?nCuSO4,则有(98m+160n)∶144×(m+n) /2=0.454∶0.288 即可得m∶n=3∶1,所以X为3Cu(OH)2?CuSO4或Cu4(OH)6SO4………………2分 (4)4∶3…………………2分;Cu4(OH)6SO4 2Cu2O+3H2O↑+SO3↑+O2↑……… 2Cu2O+3H2O↑+SO3↑+O2↑………  21、A(1) 21、A(1)  (2分) (2分)
(2) 6(1分) (1分) (3) 分子晶体 (1分) bc (2分) (4) A (2分) (5) MgCNi3 (2分) 12 (1分)
| | | 
 ,可推测其单体为尿素和甲醇
,可推测其单体为尿素和甲醇
 命名为4-甲基-2-戊烯
命名为4-甲基-2-戊烯


 A.正极的电极方程式为:O2 + 2H2O
+ 4e_ = 4OH _
A.正极的电极方程式为:O2 + 2H2O
+ 4e_ = 4OH _  A.原子核外最外层电子数:A>C>B
B.离子半径:A2->B2+>C-
A.原子核外最外层电子数:A>C>B
B.离子半径:A2->B2+>C- 学科网
学科网 学科网
学科网