
绝密★启用前【博恩试卷联考版?2009届高三第一次?化学试题?A区专用?第页(共6页)】博 恩 试 卷
联 考 版
化学试题?第一次
命题 北京博恩教育化学研究室
(试卷总分100分 考试时间100分钟)
注:本试卷以高三内容、高一第一~四单元内容为主。
第Ⅰ卷(选择题 共48分)
可能用到的相对原子质量: H:1 C:12 N:14 O:16 S:32 Ca:40 Cl:35.5
一、选择题(本题包括16小题,每小题3分,共48分。每小题只有一个最适合的选项。)
1.化学与人们的生活、健康密切相关。下列做法不合理的是( )
A.用米汤检验加碘食盐中的碘酸钾(KIO3)
B.向豆浆中加入盐卤(主要成分为MgCl2)制做豆腐
C.用灼烧和闻气味的方法区别棉织物和纯毛织物
D.用透析的手段净化尿毒症患者的血液
2.同温同压下,m g气体A与n g气体B的分子数目相同,下列说法中不正确的是( )
A.气体A与气体B的相对分子质量之比为m∶n
B.同质量的气体A与气体B,所含分子数目之比为n∶m
C.同温同压下,等体积的气体A与气体B的质量之比为m∶n
D.同温同压下,气体A与气体B的密度之比为n∶m
3.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如图)中进行的,吸收塔里还装入了大量瓷环。下列有关SO3的说法中不正确的是( )
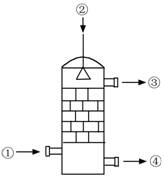
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可供稀释用的硫酸
4.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.Na2O2与H2O反应,常温常压下生成16gO2,反应中转移电子数为NA
B.
C.将5.0mol?L-1的FeCl3溶液20mL滴加到沸水中形成的胶体中,分散质粒子数为0.1NA
D.铜的电解精炼时,当阴极析出32gCu时,阳极产生的Cu2+离子数为0.5NA
5.航天飞船可用肼(N2H4)和过氧化氢为动力源。已知
A.该反应热化学方程式为:
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g);ΔH= 817.6kJ/mol
B.物质的量相同的肼(N2H4)和过氧化氢所含电子数相等
C.该动力源的突出优点之一是反应产物对环境无污染
D.肼和过氧化氢中的化学键类型及它们的晶体所属类型均相同
6.下列各项因果关系中正确的是( )
A.金刚石的熔点高于晶体硅,因为两种晶体中原子间平均距离前者小于后者
B.水的热稳定性比较高,因为水分子之间存在氢键
C.金属晶体能导电,因为金属晶体中存在金属阳离子
D.离子晶体硬度较大、难于压缩,因为离子晶体中的阴、阳离子排列很有规则
7.下列各图所示装置的气密性检查中,漏气的是( )

8.右图为某学生设计的一个实验装置,大试管中装有过氧化钠固体。现往大试管中加入水,下列说法中正确的是( )
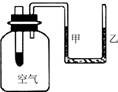
A.试管中发生了置换反应
B.一段时间后,看到“U”形管中的液面右边升高,左边下降
C.“贮存”在反应物中的总能量低于生成物的总能量
D.广口瓶中气体的分子在反应后增加
9.已知:①在淀粉-KI溶液中,滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝
②在上述蓝色溶液中,滴加过量的Na2SO3 溶液,蓝色逐渐消失
③取实验②生成的溶液滴加BaCl2溶液有白色沉淀生成
下列判断正确的是( )
A.上述实验证明氧化性:ClO->I2>SO
B.上述实验③中的白色沉淀是BaSO4,一定不含有BaSO3
C.实验①中硫酸的作用是氧化性和酸性
D.实验②证明SO既有氧化性又有还原性
10.乙二酸,又称草酸,通常在空气中易被氧化变质,而其两分子结晶水(H
A.草酸是二元弱酸,其电离方程式为H
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将乙二酸滴加到浓H2SO4上使之脱水分解,分解产物是CO2和H2O
11.下列物质属于非电解质的是( )
A.NH3 B.(NH4)2SO
12.下列关于晶体的说法一定正确的是( )
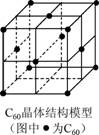
A.第ⅠA碱金属元素与ⅦA元素所形成的化合物在固态时为离子晶体,晶体中阴、阳离子排列方式相同
B.晶体中存在阴离子就必定存在阳离子,存在阳离子就必定存在阴离子
C.离子晶体中只含有离子键,分子晶体、原子晶体中必定含有共价键
D.C60晶体(其结构模型如右图)中每个C60分子周围与它距离最近且等距离的C60分子有12个
13.某含Na+的近中性溶液中,还可能含NH、Fe2+、Br-、CO、I-、SO等6种离子中的几种,现进行以下实验:
①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;
②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;
③橙黄色溶液不能使淀粉变蓝.
由此推断该溶液肯定存在的离子为( )
A.Na+、Fe3+、SO、CO B.Na+、NH、Fe2+、CO
C.Na+、Fe2+、Br-、I- D.NH、Na+、Br-、CO
14.右图中,两电极上发生的电极反应如下:a极:Cu2++2e-=Cu,b极:
Fe-2e-=Fe2+,则以下说法不正确的是( )
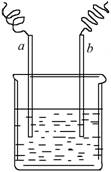
A.该装置可能是电解池
B.a极上一定发生还原反应
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
15.下列实验装置图安全正确的是( )
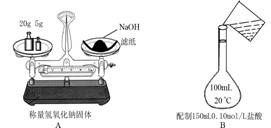

16.某学生配制100mL 1mol/L的硫酸溶液,进行下列操作,然后对溶液浓度做精确测定,发现真实浓度小于1mol/L。他的下列操作中使浓度偏低的是( )
① 用量筒来量取所需的浓硫酸时俯视读数
② 量筒中浓硫酸全部转移到烧杯中稀释,再转移到100mL容量瓶中,烧杯未洗涤
③ 用玻璃棒引流烧杯中溶液转移到容量瓶中,有溶液流到容量瓶外面
④ 用胶头滴管加蒸馏水时,不是逐滴加入,因而使溶液液面超过了刻度线,他立即用滴管吸去多余的水,使溶液的凹液面恰好与刻度线相切
A.②③④ B.③④ C.①②③ D.①②③④
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
第Ⅱ卷(非选择题 共52分)
二、非选择题(本题包括5小题,共52分)
17.(12分)将化学知识系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
序号
实际生产中采取的措施
工业生产实例(写名称)
(1)
通过增大压强提高原料转化率
(2)
使用催化剂增大反应的速率
问题2:化学反应的发生是有条件的。反应物相同,反应的条件不同,反应的原理不同。如:4Na+O2===2Na2O 2Na+O2Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:
问题3:化学反应中均伴随着能量的变化。

如果一个化学反应中,反应物的总能量和生成物的总能量有如图所示的关系,则该反应过程中的能量变化是 (填“放热”或“吸热”)。
已知金刚石和石墨分别在氧气中完全燃烧的热化学方程式为:C(金刚石、s)+O2(g)===CO2(g):ΔH=-395.41kJ/mol,C(石墨、s)+O2(g)===CO2(g):ΔH=-393.51kJ/mol,则金刚石转化石墨时的热化学方程式为:
问题4:在复杂的反应中,要考虑反应的先后顺序。已知NH+AlO+H2O===Al(OH)3↓+NH3?H2O,向含有等物质的量的NH、Al3+、H+、混合溶液中,慢慢滴加NaOH溶液,直至过量,并不断搅拌,依次发生了数个离子反应;其中
(1)第二个离子反应的离子方程式是
(2)最后一个离子反应的离子方程式是
问题5:化学反应的复杂性决定了反应方程式计量数的复杂性。对下列化学反应:
8KMnO4+15KI+17H2SO4?→8MnSO4+5I2+5KIO3+9K2SO4+17H2O
如果该反应方程式中I2和KIO3的系数不是5,可能的配平系数还有许多组。请你再写出一个配平的该反应的化学方程式:
18.(10分)电解原理在化学工业中有着的广泛应用,其中氯碱厂就是用电解饱和食盐水制取NaOH、H2、Cl2等化工原料。
(1)下图1是实验室中电解NaCl溶液装置图,X极为铁棒、Y极为石墨,电极通过导线与直流电源相连。请回答以下问题:
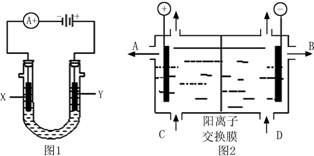
①Y电极上的电极反应式为 ,检验该电极反应产物的方法是
②通电开始后,阴极附近溶液pH会增大,请简述原因
③某学生在接入电源时,将电极连接反了,电解一段时间后溶液中的现象是
(2)上图2是工业上电解饱和食盐水用的电解槽,内装有阳离子交换膜(只允许阳离子通过,而阻止阴离子和气体通过),其工作原理如图所示。
①由C处加入的是( )
A.饱和NaCl溶液 B.纯水
C.含有少量NaOH的水 D.含有少量NaCl的水
②电解得到的氢氧化钠溶液从液体出口 (填写“A”或“B”)导出。
19.(10分) 已知:A、B 是两种盐的溶液,其焰色反应均呈黄色,A 呈中性,B呈碱性,具有氧化性并具有杀菌消毒作用;D 在CCl4中呈紫红色。下图为相关实验步骤和实验现象
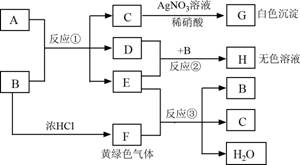
请回答:
(1)依次写出 A、B 中溶质的化学式:A ;B
(2)依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
;
(3)写出反应③的化学方程式
20.(12分)已知A、B、D、E四种物质中均含有同一种短周期元素,D为气体单质,E为黑色粉末,在图转化中E均起催化作用(某些产物已略去)。
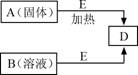
请回答:
(1)A的化学式为 ;
B分子的电子式为 。
(2)已知E与含A中某种元素的酸在一定条件下反应,产生一种含有该元素的气体X。某校化学兴趣小组为研究该气体的性质,设计下图所示装置进行实验。装置III中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
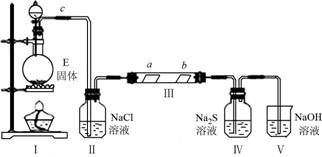
①装入药品前,检查I中气体发生装置气密性的操作是
;
②写出装置I中发生反应的离子方程式 ;
③实验过程中,观察到装置IV中出现淡黄色沉淀,其主要反应的离子方程式为 ;
④实验结束后,该组同学在装置III中观察b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为在装置(选填装置序号) 之间,还需添加洗气瓶,该装置的作用是 ;
(3)气体X能与溶液B反应,生成气体D,写出反应的化学方程式 。
四.(本题包括1小题,8分)
21.已知Cl2在
(1)写出Cl2在
(2)计算完全反应后各生成物的物质的量浓度(除H2O处).
1.A(碘单质遇淀粉变蓝色,而不是碘酸钾)
2.D(同温同压下,mg气体A与ng气体B的分子数目相同,说明物质的量相同,A、B、C正确,D同温同压下,气体A与气体B的密度之比等于它们的物质的量之比为m : n)
3.C(从③处导出的气体含有少量SO2、O2 、N2等,不可直接排入大气,否则造成污染)
4.A(B项由于不知道气体的状态,
5.A(放出热量ΔH<0,所以A错误;其它说法均正确)
6.A(水的热稳定性比较高是因为水分子中氢氧键的键能大;金属晶体导电是因为含有自由移动的电子;离子晶体硬度较大、难于压缩是因为离子键键能大)
7.D (D中上下移动时,两端液面始终平衡说明装置漏气)
8.B(过氧化钠固体与水反应,是放热反应,A、C错误;放热使广口瓶中气体温度升高膨胀,则右边升高左边下降)
9.A(ClO-+2I-+2H+===Cl-+I2+H2O;SO+I2+H2O===2I-+SO+2H+,所以可知氧化性为:ClO->I2>SO,因为②中加入过量的Na2SO3 溶液,所以③中含有BaSO3沉淀;①中硫酸只起到酸性作用,②只能证明SO有还原性)
10.C(二元弱酸应分步电离;草酸滴定KMnO4属于氧化还原滴定,不用指示剂;乙二酸脱水分解产物是CO、CO2和H2O)
11.A((NH4)2SO4和CH3COOH明显属于电解质;Cl2是单质既不属于电解质也不属于非电解质;虽然NH3的水溶液能够导电,那是由于生成了一水合氨的原因,故NH3属于非电解质。)
12.D(CsCl和NaCl的阴、阳离子排列方式不同;金属晶体中只有阳离子,没有阴离子;分子晶体中不一定含有共价键如稀有气体)
13.D(①说明有Br-、CO,有CO就没有Fe2+②说明没有SO③说明没有I-)
14.D(能发生这两个电极反应的可能是原电池,也可能是电解池,如果是原电池,则b为铁电极,a为没铁活泼的金属或非金属做电极,电解溶液为含铜离子的溶液;如果是电解池,b用铁做电极和电源的正极相连,a可以和铁相同的电极也可以不同,溶液为含铜离子的溶液)
15.C(A称量时应左物右码,B配制150mL0.10mol/L溶液应用150mL的容量瓶,而且要用玻璃棒引流;D冷凝水的方向应从下进上出)
16.D(①所取浓硫酸的体积少,②③④均造成溶质的损失)
17.问题1:(1)合成氨工业 硫酸工业(其他合理答案也正确) (2分)
问题2:Cu+4H++2NO(浓)===Cu2++2NO2↑+2H2O
3Cu+8H++2NO(稀)===3Cu2++2NO↑+4H2O(其他合理答案也正确)(2分)
化学?第页(见反面)问题3:放热 C(金刚石、s)=C(石墨、s);ΔH=-1.90kJ/mol(2分)
问题4:(1)第二个反应为:Al3++3OH-===Al(OH)3↓ (2分)
(2)最后一个离子反应为:Al(OH)3+OH-===AlO+2H2O (2分)
问题5:4KMnO4+5KI+7H2SO4===4MnSO4+I2+3KIO3+3K2SO4+7H2O (2分) (其他合理答案也正确)
18.(1)①2Cl--2e-=Cl2↑(2分) 用湿润的淀粉-KI试纸靠近Y极支管口(其它合理答案均可)(2分)
②由于2H++2e-=H2↑ 放出氢气,使水的电离平衡向正反应方向移动,使c(OH-)不断增大,所以pH会增大(2分)
③先有白色沉淀生成,继而变成灰绿色,最后变成红褐色(2分)
(2)①A(1分) ②B(1分)
19.(每空2分)(1)NaI NaClO
(2)2I-+ClO-+H2O===I2+Cl-+2OH- I2+5ClO-+2OH-===2IO+5Cl-+H2O
(3)Cl2+2NaOH===NaClO+NaCl+H2O
20.(1)KClO3 (1分) H????????H(1分)
(2)①关闭分液漏斗活塞,在II中加水,没过长导管口,用酒精灯微热圆底烧瓶,若II中有气泡冒出,停止加热后,有水进入II中的长导管,形成一段稳定的水柱,则证明I气密性良好。 (或用止水夹夹住c处,向分液漏斗中加水,打分液漏斗的活塞,若分液漏斗中的水不再下流,则证明I气密性良好。)(2分)
②MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
③S2-+Cl2===S↓+2 Cl-(2分)
化学?第页 ④II III(1分) 除去氯气中的水蒸气(或干燥氯气)(1分)
(3)Cl2+H2O2===2HCl+O2(2分)
21.(1)7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)C(NaCl)=1.8mol/L,Cl(NaClO)=0.8mol/L,C(NaClO3)=0.2mol/L (每个2分)
解析:解答此题的关键是第(1)问.可根据得失电子数相等确定生成物NaCl、NaClO、NaClO3的物质的量之比,进而确定化学方程式中化学计算数.
(1)依题意可设生成NaClO的物质的量为4mol,NaClO3的物质的量为1mol,设生成NaCl的物质的量x,根据得失电子的物质的量相等,有:1×x=1×4mol+5×1mol,解得:x=9mol.
NaCl、NaClO、NaClO3化学计量数之比与生成对应物质的物质的量相等,即等于9∶4∶1.据此可写出总的化学字方程式:7Cl2+14NaOH===9NaCl+4NaClO+NaClO3+7H2O
(2)n(Cl2)=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com