
4.下列命题错误的是: ( )
A.命题“若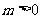 ,则方程
,则方程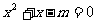 有实数根”的逆否命题为:“若方程
有实数根”的逆否命题为:“若方程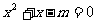 无实数根,则
无实数根,则 ”
” 
B.若 为假命题,则
为假命题,则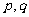 均为假命题
均为假命题
C.“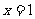 ”是“
”是“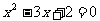 ”的充分不必要条件
”的充分不必要条件
D.若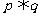 为真命题,则
为真命题,则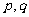 至少有一个为真命题
至少有一个为真命题
3.等轴双曲线过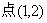 ,则它的焦点坐标为
( )
,则它的焦点坐标为
( )
A.(0,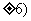 B.(
B.(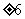 ,0) C.(0,
,0) C.(0,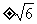 ) D.(
) D.(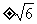 ,0)
,0)
2.已知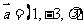 ,
, ,若
,若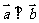 , 则
, 则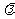 = ( )
= ( )
A. B.
B. C.2
D.3
C.2
D.3
1.条件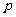 :
: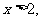
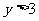 ,条件
,条件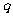 :
: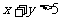 ,
,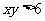 ,则条件
,则条件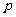 是条件
是条件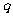 的( )
的( )
A.充分而不必要条件 B.必要而不充分条件
C.充要条件 D.既不充分也不必要条件
27.(8分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
 请回答:
请回答:
(1)以上步骤有错误的是(填编号)_____,该错误操作会导致测定结果
(填“偏大”、“偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:
(4)图19是某次滴定时的滴定管中的液面,其读数为 mL
(5)根据下列数据:请计算待测盐酸溶液的浓度:
|
滴定次数 |
待测液体积(mL) |
标准烧碱体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.30 |
20.40 |
|
第二次 |
20.00 |
4.00 |
24.20 |
|
第二次 |
20.00 |
2.00 |
24.30 |
福建省福州八县(市)一中09-10学年高二上学期期末联考
26.(16分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
|
实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.2 |
0.1 |
pH>7 |
|
丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2_______ (选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是______________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 c(OH-)-c(HA)=________mol·L-1
25.(8分)在25 ℃时,用石墨电极电解1000mL一定浓度的CuSO4溶液。5 min后电解完全,在一个石墨电极上只有1.28 g Cu生成。试回答下列问题:
(1)总反应式为 。
(2)电解过程中转移的电子数为 mol, 同时生成标准状况下气体的体积为
(3)在原CuSO4溶液中,如要生成Cu(OH)2沉淀,应调整溶液的PH为
(KspCu(OH)2=2×10-20)
24.(14分) 为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l);ΔH=-44.0KJ·moL-1
(1)氢气的燃烧热△H= kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO 的转化率为 ;反应达到平衡后,升高温度,此时平衡常数将 (填“变大”、“不变”或“变小”),平衡将向 (填“正”或“逆”)方向移动。
(4)为了提高CO的转化率,可采取的措施是 。
A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是
23.I.(4分)(1)同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4,其中
c(NH4+) 由大到小的顺序是 (填序号,下同)
(2)同浓度的下列溶液:①(NH4)2SO4 ②NH4Cl ③Na2CO3 ④NaHCO3,其中
PH 由大到小的顺序是
II.(6分)(1)明矾[KAl(SO4)2·12 H2O]水溶液呈 性 ,原因是(用离子方程表示): 。试列举它在生活中的一种用途 ;
(2)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 ;(用化学式表示,下同)
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
22. 根据化学平衡知识,判断下列说法正确的是( )
A.已知NaHA溶液呈弱碱性,则该溶液中下列各种微粒浓度大小排列顺序为:
c(Na+)>c(HA-)>c(A2-)>c(H2A)
B.在小苏打溶液中存在下列关系:c(HCO3-)=c(Na+)-c (CO32-)-c(H2CO3)
C.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com