
3、(江苏卷)15.发展基层民主,保障人民享有更多更切实的民主权利,是我国发展社会主义民主政治的重要内容。下列属于基层群众性自治组织的是
A.业主委员会 B.消费者协会 C.居民委员会 D.乡人民政府
[解析]本题考查民主管理的相关知识,考查学生的识记和理解的能力。基层群众性自治组织在我国主要是指城市中的居民委员会和农村中的村民委员会,故只有C项符合题意;AB两项属于社会团体;D项属于基层政权机关。
2、(江苏卷)14.某市民发现,当地有关行政部门的个别工作人员没有切实履行食品安全监管职责,于是打电话给该部门反映问题并提出建议。该市民行使监督权的方式是
A.社情民意反映制度 B.舆论监督制度
C.社会听证制度 D.信访举报制度
[解析]本题考查公民民主监督的方式,考查学生的识记能力。A、C两项属于公民直接参与民主决策的方式,不符合题意;舆论监督主要是通过新闻媒体发表意见,故B项不符合题意;通过题干可以看出D项正确。
1、(山东卷)19、某小区有些居民晚上经常一起打牌娱乐,影响乐一张姓居民的正常休息并引发争执,居民委员会就此召开居民会议,通过表决,会议作出了这些居民可以继续以原方式娱乐的决定。该决定
A错误,因为它没有吸纳张姓居民的意见
D正确,因为它是居民会议民主决策的结果
C错误,因为张姓居民的休息权受法律保护
D正确,因为居民的娱乐要求受法律保护
[解析]本题考查权利和义务的关系。在我国权利和义务是统一的。宪法规定“中华人民共和国公民在行使权利和自由的时候,不得损害国家的、社会的、集体的利益和其他公民的合法的自由和权利。”任何公民的合法权利都应法律保护。所以答案选C。w
2009年2月28日,十一届全国人大常委会第七次会议表决通过了《中华人民共和国食品安全法》。这部法律自2009年6月1目起施行。据此回答13-14题。
2、下列各种说法中错误的是( )
A、形成配位键的条件是一方有空轨道一方有孤对电子。
B、配位键是一种特殊的共价键。
C、配位化合物中的配体可以是分子也可以是阴离子。
D、共价键的形成条件是成键原子必须有未成对电子。
1、向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是( )
A.[Co(NH3)4Cl2]Cl B.[Co(NH3)3Cl3]
C.[Co(NH3)6]Cl3 D.[Co(NH3)5Cl]Cl2
3、根据价电子对互斥理论,判断H3O+的空间结构式
A.三角锥形 B.正四面体 C.平面正三角形 D.变形四面体
教 案
长春市第二实验中学 李佳惠
(lijiahui82@)
|
课题:第二节 分子的立体结构(2) |
授课班级 |
|
|||||||||||||||||||||||||||
|
课 时 |
|
||||||||||||||||||||||||||||
|
教 学 目 的 |
知识 与 技能 |
1.认识杂化轨道理论的要点 2.进一步了解有机化合物中碳的成键特征 3.能根据杂化轨道理论判断简单分子或离子的构型 |
|||||||||||||||||||||||||||
|
过程 与 方法 |
1、采用图表、比较、讨论、归纳、综合的方法进行教学 2、培养学生分析、归纳、综合的能力和空间想象能力 |
||||||||||||||||||||||||||||
|
情感 态度 价值观 |
|
||||||||||||||||||||||||||||
|
重 点 |
杂化轨道理论的要点 |
||||||||||||||||||||||||||||
|
难 点 |
杂化轨道理论 |
||||||||||||||||||||||||||||
|
知 识 结 构 与 板 书 设 计 |
三、杂化轨道理论简介 1、杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。 2、杂化轨道的类型: (1) sp3杂化:1个s轨道和3个p轨道会发生混杂,得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道。 空间结构:空间正四面体或V型、三角锥型。 (2) sp2杂化:同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。 sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。 (3) sp 杂化:同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。 sp杂化:夹角为180°的直线形杂化轨道, 3、AB m杂化类型的判断 公式:电子对数n=  |
||||||||||||||||||||||||||||
|
教学过程 |
|||||||||||||||||||||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
||||||||||||||||||||||||||||
|
[复习]共价键类型:σ、π键,价层电子对互斥模型。 [质疑] 我们已经知道,甲烷分子呈正四面体形结构,它的4个C--H键的键长相同,H-C--H的键角为109-28°。按照我们已经学过的价键理论,甲烷的4个C--H单键都应该是π键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的ls原子轨道重叠,不可能得到四面体构型的甲烷分子。为什么? [讲]碳原子具有四个完全相同的轨道与四个氢原子的电子云重叠成键。 [引入]碳原子的价电子构型2s22p2,是由一个2s轨道和三个2p轨道组成的,为什么有这四个相同的轨道呢?为了解释这个构型Pauling提出了杂化轨道理论。 [板书]三、杂化轨道理论简介 1、杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。 [讲]杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体结构提出的。为了解决甲烷分子四面体构型,鲍林提出了杂化轨道理论,它的要点是:当碳原子与4个氢原子形成甲烷分子时,碳原子的2s轨道和3个2p轨道会发生混杂,混杂时保持轨道总数不变,却得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道,表示这4个轨道是由1个s轨道和3个p轨道杂化形成的。当碳原子跟4个氢原子结合时,碳原子以4个sp3杂化轨道分别与4个氢原子的ls轨道重叠,形成4个C--Hσ键,因此呈正四面体的分子构型。 [投影]   [讲]杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。同时只有能量相近的原子轨道才能发生杂化,而1s轨道与2p轨道由于能量相差较大,它是不能发生杂化的。 [讲]我们需要格外注意的是,杂化轨道只用于形成σ键或者用来容纳孤对电子剩余的p轨道可以形成π键 [投影] sp3杂化轨道 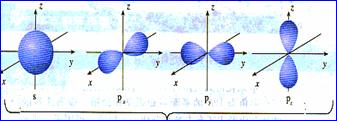  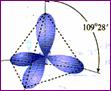 [板书]2、杂化轨道的类型: (1) sp3杂化:1个s轨道和3个p轨道会发生混杂,得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道。 [讲]价层电子对互斥模型时我们知道,H20和NH3的VSEPR模型跟甲烷分子一样,也是四面体形的,因此它们的中心原子也是采取sp3杂化的。所不同的是,水分子的氧原子的sp3杂化轨道有2个是由孤对电子占据的,而氨分子的氮原子的sp3杂化轨道有1个由孤对电子占据。 [板书]空间结构:空间正四面体或V型、三角锥型。 [讲]凡属于VESPR模型的AY4的分子中心原子A都采取sp3 杂化类型。例如CH4、NH3、H2O等。其中像CH4这类与中心原子键合的是同一种原子,因此分子呈高度对称的正四面体构型,其中的4个sp3杂化轨道自然没有差别,这种杂化类型叫做等性杂化。而像NH3、H2O这类物质的中心原子的4个sp3杂化轨道用于构建不同的σ键或孤对电子,这个的4个杂化轨道显然有差别,叫做不等性杂化, [讲]除sp3杂化轨道外,还有sp杂化轨道和sp2杂化轨道。sp2杂化轨道由1个s轨道和2个p轨道杂化而得。 [板书] (2) sp2杂化:同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。 [投影]  [板书] sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。 [投影] 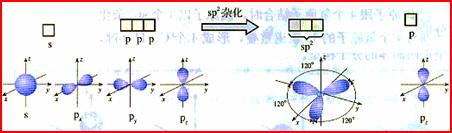 [讲]应当注意的是,杂化过程中还有未参与杂化的p轨道,可用于形成π键,而杂化轨道只用于形成σ键或者用来容纳未参与成键的孤对电子。而没有填充电子的空轨道一般都不参与杂化。 [讲]乙烯分子中的碳原子的原子轨道采用sp2杂化。其中两个碳原子间各用一个sp2杂化轨道形成σ键,用两个sp2杂化轨道与氢原子形成σ键,两个碳原子各用一个未参加杂化的2p原子轨道形成Π键。 [投影]  [讲]苯环分子中的碳原子的原子轨道采用了sp2杂化。每个碳原子上的三个sp2杂化轨道分别与两个相邻的碳原子和一个氢原子形成三个σ键并形成六碳环,每个碳原子上的未杂化2p轨道采用“肩并肩”的方式重叠形成大Π键。大Π键的形成使苯环上的所用原子处于同一平面,且结构稳定。 [投影]   [讲]sp杂化轨道由1个s轨道和1个p轨道杂化而得 [板书] (3) sp 杂化:同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。 [投影]  [板书]sp杂化:夹角为180°的直线形杂化轨道, [投影] 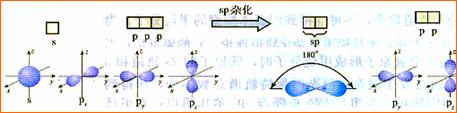 [讲]杂化轨道成键时,要满足化学键间最小排斥原理,键与键间的排斥力大小决定于键的方向,即决定于杂化轨道间的夹角。由于键角越大化学键之间的排斥能越小,对sp杂化来说,当键角为180时,其排拆力最小,所以sp杂化轨道成键时分子呈直线形;对sp2杂化来说,当键角为120时,其排斥力最小,所以sp2杂化轨道成键时,分子呈平面三角形。由于杂化轨道类型不同,杂化轨道夹角也不相同,其成键时键角也不相同,故杂化轨道的类型与分子的空间构型有关。 [讲]为了清晰的表示出成键电子和孤对电子,更有利的解释物质空间构型的关系,我们引入了路易斯式。路易斯结构式是用短线表示键合电子,小黑点表示未键合的价电子的结构式。 [投影] 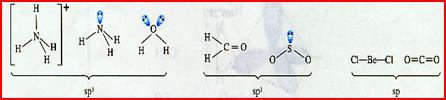 [科学探究]1、写出HCN分子和CH20分子的路易斯结构式。 2.用VSEPR模型对HCN分子和CH2O分子的立体结构进行预测(用立体结构模型表示) 3.写出HCN分子和CH20分子的中心原子的杂化类型。 4.分析HCN分子和CH2O分子中的π键。 [汇报]1、 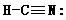 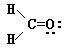 2、直线型 平面三角型 3、sp杂化 sp2杂化 4、 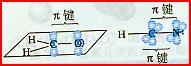 HCN分子中有2个σ键和2个Π键,即C-H和C-N之间各有一个σ键,另外C-N之间有两个Π键。甲醛分子中C-H之间有2个σ键,C-O之间有1个σ键和1个Π键 HCN分子中有2个σ键和2个Π键,即C-H和C-N之间各有一个σ键,另外C-N之间有两个Π键。甲醛分子中C-H之间有2个σ键,C-O之间有1个σ键和1个Π键[板书]3、AB m杂化类型的判断 公式:电子对数 n=  [讲]在上述公式使用时,电荷为正值时,取负号,电荷为负值时,取正号。当配位原子为氧原子或硫原子时,成键电子数为零。 [投影小结]
[讲]例如,SO2 电子对数为(6+0)/2=3,为sp2杂化。 [小结]无论是价层电子对互斥理论还是杂化轨道理论,我们都是为了合理的解释分子的空间构型, [投影]
|
|
||||||||||||||||||||||||||||
|
教学回顾: |
|||||||||||||||||||||||||||||
教 案
长春市第二实验中学 李佳惠
(lijiahui82@)
|
课题:第二节 分子的立体结构(3) |
授课班级 |
|
||||||||||||||
|
课 时 |
|
|||||||||||||||
|
教 学 目 的 |
知识 与 技能 |
1、配位键、配位化合物的概念 2、配位键、配位化合物的表示方法 |
||||||||||||||
|
过程 与 方法 |
1、采用图表、比较、讨论、归纳、综合的方法进行教学 2、培养学生分析、归纳、综合的能力 |
|||||||||||||||
|
情感 态度 价值观 |
|
|||||||||||||||
|
重 点 |
配位键、配位化合物的概念 |
|||||||||||||||
|
难 点 |
配合物理论 |
|||||||||||||||
|
知 识 结 构 与 板 书 设 计 |
四、配合物理论简介 1、配位键 (1)定义:“电子对给予-接受键”被称为配位键。一方提供孤对电子;一方有空轨道,接受孤对电子。如:[Cu(H20)2+]、NH4+中存在配位键。 (2)成键粒子:原子 (3)成键性质:共用电子对对两原子的电性作用 (4)成键条件:形成配位键的一方是能够提供孤对电子的原子,另一方是具有能够接受孤对电子的空轨道原子。 (5)配位键的表示方法:A→B(表明共用电子对由A原子提供而形成配位键) 2、配合物 (1)定义:通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。 (2)配合物的组成 中心原子:配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见。 配位体:可以是阴离子,也可以是中性分子,配位体中直接同中心原子配合的原子叫配位原子,配位原子必须是含有孤对电子的原子。 配位数:直接同中心原子配位的原子的数目叫中心原子的配位数。 配离子的电荷数:配离子的电荷数等于中心离子和配位体的总电荷数的代数和。 3、配合物的形成: Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O [Cu(NH3)4]2+深蓝色 4、配合物的性质 (1)配合物溶于水后难电离 (2)配位键越强,配合物越稳定。 |
|||||||||||||||
|
教学过程 |
||||||||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|||||||||||||||
|
[引入]我们在了解了价层电子互斥理论和杂化轨道理论后,我们再来学习一类特殊的化合物,配合物 [板书]四、配合物理论简介 [实验2-1]将表中的少量固体溶于足量的水,观察实验现象并填写表格。 [投影]
[讲]上述实验中呈天蓝色的物质是水合铜离子,可表示为[Cu(H20)2+],叫做四水合铜离子。在四水合铜离子中,铜离子与水分子之间的化学键是由水分子提供孤对电子对给予铜离子,铜离子接受水分子的孤对电子形成的,这类“电子对给予-接受键”被称为配位键。 [投影]
[板书]1、配位键 (1)定义:“电子对给予-接受键”被称为配位键。一方提供孤对电子;一方有空轨道,接受孤对电子。如:[Cu(H20)2+]、NH4+中存在配位键。 [讲]配位键是一种特殊的共价键,但形成配位键的共用电子对由一方提供而不是由双方共同提供的。 [板书](2)成键粒子:原子 (3)成键性质:共用电子对对两原子的电性作用 (4)成键条件:形成配位键的一方是能够提供孤对电子的原子,另一方是具有能够接受孤对电子的空轨道原子。 (5)配位键的表示方法:A→B(表明共用电子对由A原子提供而形成配位键) [讲]存在配位键的物质有很多,比如我们常见的NH4+、H3O+、SO42-、P2O5、Fe(SCN)3、血红蛋白等等。通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物,简称配合物。 [板书]2、配合物 (1)定义:通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。 [讲]已知配合物的品种超过数百万,是一个庞大的化合物家族。 [板书](2)配合物的组成 中心原子:配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见。 配位体:可以是阴离子,也可以是中性分子,配位体中直接同中心原子配合的原子叫配位原子,配位原子必须是含有孤对电子的原子。 配位数:直接同中心原子配位的原子的数目叫中心原子的配位数。 配离子的电荷数:配离子的电荷数等于中心离子和配位体的总电荷数的代数和。 [投影]
[讲]如:[Co(NH3)5Cl]Cl2 这种配合物,其配位体有两种:NH3、Cl-,配位数为5+1=6。 [讲]配合物的命名,关键在于配合物内界(即配离子)的命名。命名顺序:自右向左:配位体数(即配位体右下角的数字)--配位体名称--“合”字或“络”字--中心离子的名称--中心离子的化合价。例如[Zn(NH3)2]SO4读作硫酸二氨合锌 [实验2-2]向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。 [投影]
[问题]有谁上黑版写出有关的化学方程式? [板书]3、配合物的形成: Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4 NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O [Cu(NH3)4]2+深蓝色 [讲]在[Cu(NH3)4]2+里,NH3分子的氮原子给出孤对电子对,Cu2+接受电子对,以配位键形成了[Cu(NH3)4]2+ [投影]
[板书]4、配合物的性质 (1)配合物溶于水后难电离 [讲]配合物溶于水易电离为内界配离子和外界离子,而内界的配体离子和分子通常不能电离。 [魔术表演]向黑板上悬挂的一副人物素描图象上喷洒一无色溶液,结果眼眶中流出了血泪 [实验2-3]向盛有氯化铁溶液(或任何含Fe3+的溶液)的试管中滴加1滴硫氰化钾(KSCN)溶液,观察实验现象。 [实验现象]看到试管里溶液的颜色跟血液极为相似。 [讲]这种颜色是三价铁离子跟硫氰酸根(SCN-)离子形成的配离子。利用该离子的颜色,可鉴定溶液中存在Fe3+;又由于该离子的颜色极似血液,常被用于电影特技和魔术表演。 [讲]配位键的强度有大有小,因而有的配合物很稳定,有的很不稳定。许多过渡金属离子对多种配体具有很强的结合力,是因为过渡金属原子或离子都有接受孤对电子的空轨道,对多种配体具有较强的结合力,因而,过渡金属配合物远比主族金属配合物多。 [板书](2)配位键越强,配合物越稳定。 [投影]科学视野:已知的配合物种类繁多,新的配合物由于纷繁复杂的有机物配体而层出不穷,使得无机化合物的品种迅速增长。叶绿素、血红素和维生素B12都是配合物,它们的配体大同小异,是一种称为卟啉的大环有机物,而中心离子分别是镁离子、亚铁离子和钴离子。图2-25是叶绿素的结构示意图:
[实践活动]用计算机软件Chemsketch制作分子立体模型。 练习1、制作甲烷分子的立体结构模型 步骤:(1)在程序第一个界面“Chemsketch
Window” (化学作图视窗)上(当界面上的 (2)点击视窗左下角的“Copy to 3D”,进入该程序的第二个界面“ACD/3D”(三维模型视窗),出现一个球; (3)点击该界面上的图标 (4)用鼠标点住模型移动,模型将随之旋转; (5)点击图标 (6)点击图标 (7)点击左下角“C11ernsr返回第一个界面,用鼠标点击图标图,直至界面清空。 练习2、制作水分子的立体结构模型 步骤:(1)用鼠标点击左侧的图标“O”,使该图标变为白色背景,在界面上点击一次,出现“H2O”; (2)重复练习l的(2)一(7)的操作。 练习3、制作氨分子结构模型 步骤:(1)用鼠标点击左侧的图标“N”,使该图标变为白色背景,在界面上点击一次,出现“NH3”; (2)重复练习l的(2)一(7)的操作。 练习4、制作二氧化碳分子结构模型 步骤:(1)用鼠标点击左侧的图标“C”,使该图标变为白色背景,在界面土点击一次,出现“CH4”,用鼠标点击左侧的图标“O”,然后用鼠标点住界面上“CH4”,向任一方向拖拉鼠标,图形变为“CH3一OH”,再用鼠标,长住图形“CH3一OH”中的“CH3向任一方向拖拉鼠标,图形变为HO (2)重复练习1的(2)一(7)的操作。 [小结]在工业生产中,配合物的性质应用于湿法冶金、物质的分离和提纯、合成功能分子。在定量分析中,用于检验离子、作隐蔽剂、有机沉淀剂和萃取分离等。配合物还和生物体内许多酶与金属离子的配合物有关。 [随堂练习] 2、用VSEPR模型预测,下列分子中键角不是1200的是 A.C2H2 B.C6H6 C.BF3 D.NH3 1、用VSEPR模型预测,下列分子形状与H2O相似,都为V型的是 A.OF2 B.BeCl2 C.SO2 D.CO2 2、由于表面活性剂会分散在水的液体表面形成一层疏水基团朝向空气的“单分子层”,又称“单分子膜”。双分子膜是由大量两性分子组装而成的, 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |