
12、下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同
11、甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 ( )
A.X+2 B.X+4 C.X+8 D.X+18
10、下列关于稀有气体的叙述不正确的是  (
)
(
)
A.原子的最外电子层都有8个电子
B.其原子与同周期IA、IIA族阳离子具有相同的核外电子排布
C.化学性质非常不活泼
D.原子半径比同周期ⅦA族元素原子的大
9、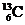 -NMR(核磁共振)可以用于含碳化合物的结构分析。
-NMR(核磁共振)可以用于含碳化合物的结构分析。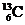 表示的碳原子 ( )
表示的碳原子 ( )
A.核外有13个电子,其中4个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
5、X、Y、Z和R分别代表四种元素,如果四种aXm+、bYn+、cZn-、dRm-离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是 A、a-c=m-n B、a-b=n-m C、c-d=m+n D、b-d=n+m 6、硼有两种天然同位素510B、511B,硼元素的相对原子质量为10.80,则对硼元素中510B质量百分含量(即质量分数)的判断正确的是 A、20% B、略大于20% C、略小于20% D、80% 7、R为短周期元素,其原子所具有的电子层数为最外层电子数的1/2,它可能形成的常见的含氧酸根离子有: ①R2O42- ②RO42- ③R2O32- ④RO32-。下列判断正确的是 A、若它能形成①时,则不可能形成②,③ B、若它能形成②时,则还可以形成③,④ C、若它能形成②时,则不可能形成④ D、若它能形成①时,则不可能形成④ 8、第二主族元素R的单质及其相应氧化物的混合物12g,加足量水完全反应后蒸干,得到的固体16克,试推测该元素可能为( ) A.Mg B、Ca C、Sr D、Ba
1、美国科学家将两种元素铅和氢的原子核对撞,获得了一种质子数为118,中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A.57 B.47 C.61 D.293
2、已知某元素阴离子Rn-的原子核内的中子数为(A-x+n),其中A为原 子的质量数。则mg Rn-中的电子总数为( )
A.
子的质量数。则mg Rn-中的电子总数为( )
A.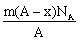 B.
B. C.
C. D.
D.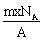 3、在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为电子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
4、 下列说法正确的是( )
A.原子核都是由质子和中子构成
B.质量数跟原子的相对原子质量相等
C.质子数相同的粒子其化学性质不一定相同
D.某种粒子最外层上有8个电子,则一定是稀有气体元素的原子
3、在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同。当它作为电子的次外层时,其电子数比(n-1)层多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
4、 下列说法正确的是( )
A.原子核都是由质子和中子构成
B.质量数跟原子的相对原子质量相等
C.质子数相同的粒子其化学性质不一定相同
D.某种粒子最外层上有8个电子,则一定是稀有气体元素的原子
6. 核外电子排布的表示方法
核外电子排布的表示方法
⑴原子结构简(示意)图: 圆圈内数字表示质子数,弧线表示能层(电子层),弧线内数字表示该能层(电子层)中的电子数。如镁原子的原子结构简图为(见右图):
⑵电子排布式:在能级符号的右上方用数字表示该能级上排布的电子数目的式子。有原子的电子排布式、原子最外层的电子排布式、离子的电子排布式等不同的用法。
例如,氯原子的电子排布式为1s22s22p63s23p5;氯离子Cl-的电子排布式为1s22s22p63s23p6;氯原子最外层的电子排布式3s23p5。
为避免电子结构过长,通常把内层已达到稀有气体的电子层写成“原子芯”(原子实),并以稀有气体符号加方括号表示。例如: 氯 [Ne]3s23p5 钪 [Ar] 3d14s2
⑶轨道表示式:表示电子所处轨道及自旋状态的式子。
如7N的轨道表示式为 1s 2s 2p
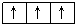 ↑↓ ↑↓
↑↓ ↑↓
|

[例1](2010山东卷,32)
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn-Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
解析:(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2P轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×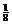 =1个,Ba2+:1个,O2-:12×
=1个,Ba2+:1个,O2-:12×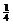 =3个,故化学式为:PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,故每个Ba2+与12个O2-配位
=3个,故化学式为:PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,故每个Ba2+与12个O2-配位
答案:(1) sp2 范德华力
(2) C>H >Si
(3) <
[例2](2010安徽卷,25)
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+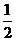 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0 kJ·mol-2
H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g)  H=-296.0
kJ·mol-1
H=-296.0
kJ·mol-1
此反应的热化学方程式是 。
答案:(1)3 VIA HClO4
(2)2 H-Z H-Y
(3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2
(4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol
解析:由表中可知,X为C Y为 S Z为 Cl W为Cu
|

第3课时 相对原子质量
同位素及相对原子质量
|
同 位 素 |
定义 |
具有相同质子数和不同中子数的同一元素的原子互称同位素 |
|
特性 |
1.
同一元素的各种同位素化学性质几乎完全相同. 2. 天然存在的某种元素里,不论是游离态还是化合态,各种同位素的原子含量一般是不变的. |
|
|
判定 方法 |
它反映的是同种元素的不同原子间的关系.故单质、化合物间不可能是同位素。如H2和D2及H2O和D2O之间不存在同位素关系。只有质子数相同而中子数不同的原子才是同位素;如168O和188O是同位素,而且146C和147N不是同位素。 |
|
|
注意 |
天然存在的元素中,许多都有同位素(但并非所有元素都有同位素)。因而发现的原子种数多于元素的种数。 |
|
相对原子 质量和近似相对原子质量 质量和近似相对原子质量 |
同位素的相对原子质量和近似相对原子质量 |
按初中所学的相对原子质量的求算方式是:一个原子的质量与一个12C原子质量的 的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。 的比值。显然,所用原子质量是哪种同位素原子的质量,其结果只能是该同位素的相对原子质量。故该定义严格说应是同位素的相对原子质量。该比值的近似整值即为该同位素的近似相对原子质量,其数值等于该同位素的质量数。 |
|
元素的相对原子质量和近似相对原子质量 |
因天然元素往往不只一种原子,因而用上 述方法定义元素的相对原子质量就不合适了。元素的相对原子质量是用天然元素的各种同位素的相对原子质量及其原子含量算出来的平均值。数字表达式为 述方法定义元素的相对原子质量就不合适了。元素的相对原子质量是用天然元素的各种同位素的相对原子质量及其原子含量算出来的平均值。数字表达式为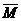 =M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。 =M1×a1%+M2×a2%+……。若用同位素的质量数替代其相对原子量进行计算,其结果就是元素的近似相对原子质量(计算结果通常取整数)。我们通常采用元素的近似相对原子质量进行计算。 |
|

[例1](汕头二模)某元素一种同位素的原子的质 子数为m,中子数为n,则下列说法正确的是( )
子数为m,中子数为n,则下列说法正确的是( )
A.不能由此确定该元素的原子量
B.这种元素的原子量为(m+n)
C.若碳原子质量为w g,此原子的质量为(m+n)w g
D.核内中子的总质量小于质子的总质量
[解析]元素的相对原子质量是各同位素相对原子质量的平均值,所以A正确,B不正确。由相对原子质量的概念,若设该核素一个原子的质量为x,并且我们用该核素的质量数代替核素的相对原子质量时,方有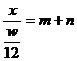 ,即x=
,即x=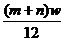 ,C不正确。在原子核内,一个中子的质量比一个质子的质量略大,但核内的质子数和中子数无法确定,因此D不正确。
,C不正确。在原子核内,一个中子的质量比一个质子的质量略大,但核内的质子数和中子数无法确定,因此D不正确。
[答案]A
[规律总结]分清相对原子质量、质量数的有关概念,切不可用核素的相对原子质量代替元素的相对原子质量。
[例2]元素周期表中ⅠA族元素有R′和R″两种同位素, R′和R″的原子量分别为a和b,R元素中R′和R″原子的百分组成分别为 x 和 y ,则R元素的碳酸盐的式量是
A.2(ax+by)+60 B. ax+by+60 C.(ax+by)/2+60 D. ay+bx+60
[ 解析]本题考察元素(平均)相对原子质量的计算。根据题给信息,R元素有两种同位素,其(平均)相对原子质量为(ax+by)。根据ⅠA族元素R的碳酸盐的化学式为R2CO3,求得其相对分子质量。答案:A。
原子结构单元检测
5.核外电子排布的一般规则
⑴每个电子层(主量子数为n)所能容纳的电子数最多为2n2个(泡利原理)。
⑵原子最外层电子数目不能超过8个(K层为最外层时不能超过2个);能级交错。
⑶原子次外层电子数目不能超过18个(K层为次外层时不能超过2个)。能级交错。
4.原子光谱
⑴基态:电子按构造原理的顺序进入原子核外的轨道,此时整个原子的能量最低,称之为基态。
基态原子是处于最低能量状态的原子。
⑵激发态:基态原子的电子吸收能量后,电子会跃迁到较高的能级,此时原子的能量较基态高,叫激发态。
基态和激发态间、不同激发态间能量是不连续的,像楼梯的台阶一样。
⑶电子的跃迁:电子由较高能量的激发态(可有多个激发态)跃迁到较低能量的激发态或基态时,会放出能量,发光是释放能量的主要形式之一。反之,电子由较低能量的基态或激发态跃迁到激发态或能量较高的激发态时,会吸收能量,吸收光是吸收能量的形式之一。
⑷原子光谱:不同元素原子的电子发生跃迁时,会吸收或释放不同波长的光,可以用光谱仪来记录、鉴别,称之为原子光谱。
在现代化学中,利用不同元素的原子光谱上的特征谱线来鉴定元素,称为光谱分析。
3.泡利原理和洪特规则
⑴泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。
⑵洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则。比如,p3的轨道式为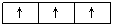
 或
或
 ,而不是
,而不是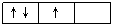
 。
。
⑶洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com