
28. (本题16分)(本题14分)A、B、C、D、E、F是元素周期表中连续三个短周期的元素,且原子序数依次增大。A与D同主族,B、C同周期且相邻,C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与F的最外层电子数相等,E的简单离子为同周期中离子半径最小的。
回答下列问题:
(1)A与B形成的一种液态化合物M与C的一种单质的摩尔质量相等,则M的化学式为
。
(2)A和C形成的一种具有氧化性的液态化合物N与M恰好完全反应,产生两种无毒又不污染环境的物质X和Y。已知:1molM与氧气反应生成X和Y放出的热量为Q1kJ,N生成1 molC单质吸收的热量为Q2kJ。请写出常温常压下M与N反应的热化学方程式
。
(3) A与B形成的另一种气态化合物Z,写出实验室制取Z的化学方程式
。
A与B形成的另一种气态化合物Z,写出实验室制取Z的化学方程式
。
(4)C与D按原子个数比1:1所形成的化合物的电子式 。
(5)六种元素中其中三种元素组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因 。
(6)E的单质与D的最高价氧化物的水化物反应的化学方程式 。
(7)A单质与C的单质组成新型燃料电池,写出以KOH为电解质溶液的负极反应式
。
27.(本题16分)现有A、B、C、D、E、F、G、H
8种钠盐,它们可能是NaCl、NaClO、Na2SO3、NaHSO4、C6H5ONa、NaHCO3、NaI、NaAlO2中的某一种。为验证各种物质的具体成分,将固体样品分别配成溶液 后进行如下实验:
后进行如下实验:
① 将D溶液分别加入到其它溶液中时,A、F中有气体产生,C、E中有浑浊现象出现,当加入的D过量时,E中的浑浊现象消失。
② B与G溶液混合时,溶液的颜色明显加深,如果再滴加A溶液,溶液的颜色褪去又变成无色溶液。
③ 经测定溶液G、H的pH值均为7。
请回答下列问题:
(1)根据以上实验,将你可以判断出的物质及其相应编号填入下表(填A~H对应的化学式):
|
编 号 |
A |
B |
C |
D |
E |
F |
G |
H |
|
物 质 |
|
|
|
|
|
|
|
|
(2) 当向B与H组成的浓溶液中加入固体D时,会发生反应并产生气体,写出这一过程中所发生反应的离子方程式:
(3) 所得8种溶液中,其中能促进水电离的是 (填编号,下同),抑制水电离的是 。
(4) 当F和E混合时,也会产生沉淀,写出相应的离子方程式: 。
26.(本题14分)“绿色试剂”双氧水可作为采矿业废液的消毒剂,可消除采矿业废液中的氰化物(如:KCN),化学方程式为:KCN + H2O2 + H2O == A + NH3↑ 。
(1)生成物A的化学式为 ,反应中被氧化的元素为 。
(2)在标准状况下有0.448 L氨气生成,则转移的电子数为 。
(3)双氧水有多种性质:Na2O 2 +2HCl == H2O2 +2NaCl,这个反应体现了双氧水的 性;向含有酚酞的NaOH溶液中滴加H2O2,溶液红色褪去,体现了双氧水的 性;将H2O2加入酸化的KMnO4溶液中,溶液的紫红色消失,这体现了双氧水的 性。
(4)H2O2被称为绿色氧化剂的理由是 。
13. 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A. X、M两种元素只能形成X2M型化合物
B. 由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C. 元素Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理中的消毒剂
第Ⅱ卷
12. 强酸与强碱的稀溶液发生中和反应的热化学方程式为:
H+(aq)+ OH-(aq) == H2O(l); △H = -57.3kj·mol-1。
1L 0.5mol·L-1的NaOH溶液中加入下列物质:① 稀醋酸 ② 浓硫酸 ③稀硝酸恰好完全反应的热效应△H1、△H2、△H3的关系正确的是
A. △H1>△H2>△H3 B. △H1<△H3<△H2
C. △H2>△H1>△ H3 D. △H1>△H3>△H2
11. 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体。它无色、无臭,在潮湿的空气中能发生下列反应: 3NF3+5H2O == 2NO+HNO3+9HF。下列有关说法正确的是
A. 反应中NF3是氧化剂,H2O是还原剂
B. 反应中被氧化与被还原的原子物质 的量之比为2∶1
的量之比为2∶1
C. 若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D. NF3在潮湿空气中泄漏会产生白雾、红棕色气体等现象
10. 能正确表示下列反应的离子方程 式是
式是
A.将铜屑加入 溶液中:
溶液中: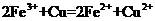
B.将磁性氧化铁溶于盐酸: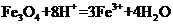
C.将氯化亚铁溶液和稀硝酸混合: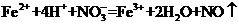
D.将铁粉加入稀硫酸中: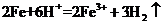
9. 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A. 元素A、B组成的化合物常温下一定呈气态
B. 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C. 工业上常用电解法制备元素C、D、E的单质
D. 化台物AE与CE含有相同类型的化学键
8. 和
和 是氧元素
是氧元素 的两种核素,
的两种核素,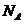 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是
A.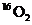 与
与 互为同分异构体
互为同分异构体
B.  与
与 核外电子排布方式不同
核外电子排布方式不同
C.通过化学变化可以实现 与
与 间的相互转化
间的相互转化
D.标准状况下,1.12L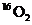 和1.12L
和1.12L 均
均 含有0.1
含有0.1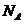 个氧原子
个氧原子
7.下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com