
31.红磷P(S)和Cl2发生反应生成KCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
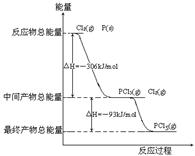 上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解
率α1等于 ;若反应温度由T1升高
到T2,平衡时PCl5分解率α2,α2 α1
(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2
反应生成中间产物PCl3,然后降温,再和Cl2
反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的
△H3= ;P和Cl2一步反应生成
1mol PCl5的△H4 △H1(填“大于”,“小于”或“等于”);
(5)P Cl5与足量水反应,最终生成两种酸,其化学方程式是 。
30.某钠盐溶液可能含有阴离子NO3-、CO32-、SO32-、SO42-、Cl-、Br-、I-、为鉴别这些离子,分别取少量溶液进行以下实验:
①测得混合液呈碱性;
②加HCl后,生成无色无味气体,该气体能使饱和石灰水溶液变浑浊;
③加CCl4后,滴加少量氯水,振荡后,CCl4后层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀。
(1)分析上述5个实验,写出每一步实验鉴定离子的结论与理由。
实验① ;
实验② ;
实验③ ;
实验④ ;
实验⑤ ;
(2)上述5个实验不能确定是否存在的离子是 。
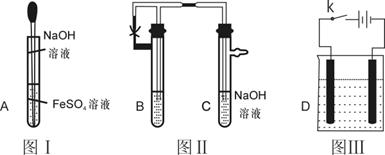
29.Fe(OH)2中一种白色沉淀,在空气中或在含有O2的水中容易被氧化而变色,难以看到它的“真面目”。为了解决这个问题,许多科学家对此实验作了研究和改进,以下三个图有一定的代表性。
(1)按照常规实验的要求,用胶头滴管滴加溶液时 (填“能”或“不能”)伸入试管中,原因是 ,图I中,长胶头滴 管伸入液面下的目的是 ;
(2) 在图Ⅱ中,要观察到Fe(OH)2的生成,B管中的试剂可以是
实验操作的步骤是(反应试剂已加入)
①
②
若操作步骤①和②颠倒,能否看到Fe(OH)2白色沉淀?试说明理由:
(3)若用图Ⅲ装置实验,阳极材料应选用 ,阴极用石墨,阳极反应 ,阴极反应是 ,该实验有一明显的不足,不利于长久清楚地看到Fe(OH)2白色沉淀的生成,请指出并设法克服。 。
28.采用惰性电极从NO3-、SO42-、Cl-、Cu2+、Ba2+、H+中选出适当的离子组成电解质,并对其溶液进行电解(少写多写均扣分)。
(1)若两极分别放出H2和O2,则电解质的化学式为 ;
(2)若阴极析出金属,阳极放出O2,则电解质的化学式为 ;
(3)若两极分别放出气体,且体积比为1:1,则电解质的化学式为 。
27.A、B、C三只烧杯中,依次分别盛有NaOH溶液、KSCN溶液、煮沸的蒸馏水,各滴入FeCl3溶液,试根据实验现象分别回答以下问题:⑴分别写出三只烧杯中形成分散系的名称:
A , B C 。
⑵写出A中形成分散系的离子方程式 。
⑶写出C中形成分散系的化学方程式 。
26.在①渗析 ②盐析 ③凝聚 ④溶胶 ⑤凝胶 ⑥布朗运动 ⑦电泳 ⑧丁达尔现象 ⑨中和 ⑩水解中选出适宜的词语填入下列每小题的空格中(填编号):
(1)肥皂水中透过强光,可以见到光带。这种现象称为___________。
(2)在浓肥皂水中加入饱和食盐水(或固体含有的细粒)肥皂凝聚。这种现象称为____。
(3)在肥皂水中加入酚酞变成红色,说明高级脂肪酸根离子发生了______________。
(4)在氢氧化铁胶体中加入硫酸铵,产生红褐色沉淀,这种现象叫做_____________。
(5)用半透膜把制取的氢氧化铁胶体中含有的NaCl分离出来的方法叫做_________。
25.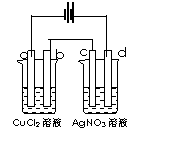 如右图,以惰性电极材料为电极进行电解,
如右图,以惰性电极材料为电极进行电解,
在a、b、c、d各电极上析出生成物的物质的量
比例关系正确的是:( )
A.1:1:1:1
B.2:2:1:1
C.2:2:4:1
D.1:2:2:4
24.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种
反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);
△H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);
△H=-192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
23.已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是 ( )
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
22.最近科学家们发现一种由钛原子和碳原子构成的气态团簇分子,如图
所示。顶点和面心的原子是钛原子,棱的中心和体心的原子是碳原子,
则它的化学式是 ( )
A.TiC B.Ti6C7
C. Ti14C13 D.Ti13C14
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com