
2.一个人提住一桶水感觉很累,如果两个人同时用力提住这桶水,感觉一定轻松些吗?
简答:不一定。如果两个人施加的拉力的方向之间的夹角很大,每个人施加的拉力要很大才可能提住这桶水,故感觉会更累些。
重点聚焦
1.一个物体放在光滑的斜面上,没有受到沿斜面向下的力,为什么物体能沿斜面下滑呢?
简答:物体之所以能沿斜面下滑,是因为物体受到重力的作用,重力的一个作用效果是使物体下滑。
3.(必修1学案)5力的分解
问题导入
(二)有关Na2O2与CO2、H2O的反应的几个重要关系
2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2↑。
1、物质的量的关系:无论是CO2或H2O的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O与放出O2的物质的量之比均为2︰1。
2、气体体积关系:若CO2和水蒸气的混合气体(或单一气体)通过足量Na2O2,气体体积的减少量等于原混合气体体积的1/2且等于生成氧气的体积。
3、电子转移关系:当Na2O2与CO2、H2O反应时,物质的量关系为2Na2O2-O2-2e-。
4、固体质量关系:相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO=Na2CO3、Na2O2+H2=2NaOH(实际上两反应不能发生)。
5、先后顺序关系:一定量的Na2O2与一定量的CO2和H2O(g)的混合物的反应,可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应。
6、应用指南:凡分子组成符合(CO)m·(H2)n的物质,Wg该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量的Na2O2后,Na2O2固体增重必为Wg。中学阶段常见的符合这一关系的物质有:
(1)无机物:H2、CO及H2、CO的混合气体;
(2)有机物:CH4O(甲醇)、CH2O(甲醛)、CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、CH3CH(OH)COOH(乳酸)、C6H12O6(葡萄糖)。
[思考感悟]金属钠露置在空气中会发生什么样的变化?最终生成什么物质?
银白色Na与空气中的O2反应形成Na2O,表面变暗,再与H2O反应形成NaOH,吸收H2O潮解形成NaOH浓溶液,再吸收CO2形成白色块状固体Na2CO3·10H2O,风化成白色粉末Na2CO3。
[基础训练]
1、(多选)将金属钠分别投入下列物质的溶液中,有气体放出,且溶液质量减轻的是( C、D )
A、 HCl B、K2SO4 C、CuCl2 D、饱和NaOH溶液
2、将一小块钠投入盛5mL饱和澄清石灰水的试管里,不可能观察到的现象是( C )
A、钠熔成小球并在液面上游动 B、有气体生成
C、溶液底部有银白色物质生成 D、溶液变浑浊
3、(多选)下列关于钠的叙述正确的是( B、D )
A、将4.6g金属钠放入95.4g蒸馏水中,可得到溶质的质量分数为8%的溶液
B、用钠与空气反应制纯净的Na2O2,空气必须经碱石灰处理后,才能与钠反应
C、钠与钠离子都具有强的还原性
D、钠跟酒精反应比跟水反应缓慢,所以残余的钠可用酒精处理
[高考模拟]
4、(2007全国卷Ⅱ)在一定条件下,将钠与氧气反应的生成物1.5g溶于水,所得溶液恰好能被80mL浓度为0.50mol·L-1的HCl溶液中和,则该生成物的成分是( C )
A、Na2O B、Na2O2 C、Na2O和Na2O2 D、Na2O2和NaO2
(先求出n(Na)=0.04mol,则m(Na2O)=1.24g<1.5g,m(Na2O2)=1.56g>1.5g)
5、(2008聊城模拟)某溶液含有①NO3-,②HCO3-,③SO32-,④CO32-,⑤SO42-等五种阴离子。向其中加入少量的Na2O2固体后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)( B )
A、① B、①④⑤ C、①③⑤ D、①③④⑤
[作业]
1、Na2O2与SO2反应:Na2O2+SO2=Na2SO4。
2、Na2O2投入FeCl2溶液中,可将Fe2+氧化成Fe3+,同时生成Fe(OH)3沉淀。
3、Na2O2投入Na2SO3溶液,可将SO32-氧化成SO42-。
4、Na2O2具有漂白性,投入品红溶液中,可使品红溶液褪色。
|
化学式 |
Na2O |
Na2O2 |
|
阳、阴离子数比 |
Na+和O2-之比为2︰1 |
Na+和O22-之比为2︰1 |
|
氧的化合价 |
-2价 |
-1价 |
|
类别 |
氧化物(碱性氧化物) |
过氧化物(不属于碱性氧化物) |
|
与H2O反应 |
Na2O+H2O=2NaOH |
2Na2O2+2H2O=4NaOH+O2↑ |
|
与CO2反应 |
Na2O+CO2=Na2CO3 |
2Na2O2+2CO2=2Na2CO3+O2 |
|
与盐酸反应 |
Na2O+2HCl=2NaCl+H2O |
2Na2O2+4HCl=4NaCl+2H2O+O2↑ |
|
稳定性 |
不稳定 |
较稳定 |
|
用途 |
---- |
制备双氧水等 |
(三)钠的化学性质:1、钠与氧气反应
 (1)常温下Na与O2反应生成Na2O(白色),化学方程式:4Na+O2=2Na2O。
(1)常温下Na与O2反应生成Na2O(白色),化学方程式:4Na+O2=2Na2O。
 (2)Na在O2中燃烧时生成Na2O2(淡黄色),化学方程式:2Na+O2 Na2O2。
(2)Na在O2中燃烧时生成Na2O2(淡黄色),化学方程式:2Na+O2 Na2O2。
2、钠与氯气反应:Na在Cl2中燃烧,生成NaCl,化学方程式为2Na+Cl2 2NaCl。
3、与H2O反应:(1)钠与水(加入酚酞)反应的实验现象和解释
A、钠浮在水面上(浮)--钠的密度比水小。
B、立刻熔成一个闪亮的小球(熔)--钠的熔点低,钠与水反应放热。
C、在水面上四处游动,发出“嘶嘶”的响声,最后完全消失(游、响)--钠与水剧烈反应生成气体(H2)。
D、反应后溶液由无色变为红色--钠与水反应生成碱性(NaOH)物质。
 (2)化学方程式为:2Na+2H2O=2NaOH+H2↑。
(2)化学方程式为:2Na+2H2O=2NaOH+H2↑。
4、与熔融金属卤化物的反应:与熔融TiCl4的反应为:4Na+TiCl4 Ti+4NaCl。
(二)钠的物理性质:银白色金属,质软,密度比水小,常保存在煤油中,熔点低。
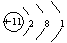 (一)钠的原子结构及存在
(一)钠的原子结构及存在
钠的原子结构示意图为 ,很容易失去最外层的电子,表现出强还原性,因此在自然界中以化合态存在。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com