
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.熔融NaCl能导电,是因为通电时NaCl发生了电离
B.NaCl固体不导电,因为NaCl固体中无带电微粒
C.NH4NO3电离时产生了NH![]() 、NO
、NO![]() ,无金属离子,所以NH4NO3不是盐
,无金属离子,所以NH4NO3不是盐
D.NaHSO4在水溶液中电离生成了Na+、H+、SO![]() 三种离子
三种离子
查看答案和解析>>
科目: 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
科目: 来源: 题型:
【题目】下列相关化学用语表述正确的是( )
A. NH4Cl的电子式: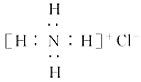
B. C原子的轨道表示式: ![]()
C. 冰醋酸为共价化合物,受热熔融:CH3COOH![]() CH3COO-+H+
CH3COO-+H+
D. Fe2+基态核外电子排布式为1s22s22p63s23p63d6
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L、体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100nL,Va、Vb与混合液的p的关系如图所示。下列说法正确的是

A. Ka(HA)=Kb(BOH)=1×10-6B. b点时,c(A-)=c(B+)=c(H+)=c(OH-)
C. c点时,c(A-)>c(B+)D. a→c过程中![]() 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G是前四周期的七种元素,其原子序数依次增大。A的基态原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图(D的氢化物沸点最高);F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
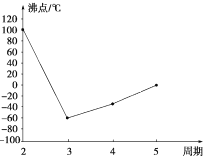
(1)写出F元素基态原子的核外电子排布式:____________。
(2)B、C、D三种元素电负性由大到小的顺序是____________(用元素符号表示)。
(3)有关上述元素的下列说法,正确的是________(填序号)。
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的立体构型为________,1 mol B2A4分子中含有________个σ键;
查看答案和解析>>
科目: 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是

A. 放电时,Mo箔上的电势比Mg箔上的低
B. 充电时,Mo箔接电源的负极
C. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的有关数据,根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸的物质的量浓度是___mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制100mL物质的量浓度为2.00mol/L的稀盐酸。
①该学生需要量取___mL(保留一位小数)上述浓盐酸进行配制。
②需要使用的实验仪器有:烧杯、玻璃棒、量筒、__和___。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写“偏大”、“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视___;
b.向容量瓶中滴加蒸馏水定容时俯视__;
c.转移前,容量瓶中含有少量蒸馏水__。
(4)取所配制的2mol/L的稀盐酸50mL,加入足量的碳酸钙固体,求可以制得标准状况下的CO2气体体积___?若忽略反应过程中的体积变化,求所得溶液中CaCl2的物质的量浓度?(写出解题过程)。___
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
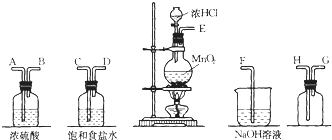
(1)连接上述仪器的正确顺序是:E接__,__接__,__接__,__接F。
(2)气体发生装置中进行的反应化学方程式是__;当0.5molMnO2参与反应时,生成的Cl2在标准状况下的体积约__。
(3)在装置中:①饱和食盐水的作用是__,②浓硫酸的作用是___。
(4)化学实验中检验是否有Cl2产生常用湿润的淀粉-KI试纸。如果有Cl2产生,可观察到的现象是___。
(5)写出尾气吸收装置中进行的反应的化学方程式__。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)将质量比为4:5的SO2和SO3混合,则混合气体中SO2和SO3的物质的量之比为__,硫原子和氧原子个数之比为___。
(2)将5mol/L盐酸10mL稀释到200mL,稀释后溶液的物质的量浓度是__。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__。
(4)已知15.6gNa2X固体中含有0.4molNa+。请计算:
a.X的相对原子质量为__。
b.将39gNa2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为___mol/L。
(5)质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最小的是__;密度最小的是__。(填化学式)
(6)漂白粉是用Cl2与___(填化学式)反应来制取的,漂白粉是___(填“混合物”或“纯净物”),其有效成分为__(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B.同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C.配制450mL0.1molL-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
D.1L0.45molL-1NaCl溶液中Cl-的物质的量浓度比0.1L0.1 molL-1AlCl3溶液大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com