
科目: 来源: 题型:
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
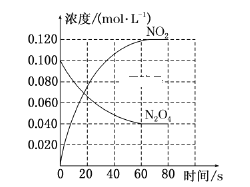
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)之后才能排放。
(1)CO和H2可作为能源和化工原料,应用十分广泛。 反应CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如表所示。
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为________。
(2)在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g) ![]() 2CO2(g) ΔH=566.0 kJ·mol1
2CO2(g) ΔH=566.0 kJ·mol1
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+180.5 kJ·mol1
2NO(g) ΔH=+180.5 kJ·mol1
③2NO(g)+O2(g) ![]() 2NO2(g) ΔH=116.5 kJ·mol1
2NO2(g) ΔH=116.5 kJ·mol1
回答下列问题:
①CO的燃烧热为 _________。 若1 mol N2(g)、1 mol O2(g) 分子中化学键断裂时分别需要吸收946 kJ、498 kJ的能量,则1 mol NO(g) 分子中化学键断裂时需吸收的能量为_________kJ。
②写出CO将NO2还原为单质反应的热化学方程式为__________________________________________
(3)汽车排气管上的催化转化器,发生上述的CO将NO2还原为单质反应。在一定温度下,将一定量的CO和NO2充入2L固定容积的容器中,回答以下问题:
①从反应开始到5min,生成了0.08mol N2,则5min内υ(CO)=___________________molL1min1。
②25min时,物质浓度变化如图所示,则改变的条件可能是___________(填字母标号)。
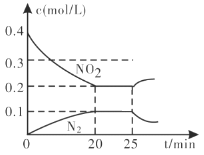
A.缩小容器体积 B.增加NO2的浓度 C.降低温度 D.升高温度
查看答案和解析>>
科目: 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
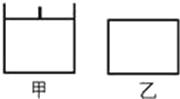
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,H2S的Ka1=1.0×10-7,Ka2=7.0×10-15。下列说法正确的是
A.0.1 mol·L-1的NaHS溶液中:c(S2-)>c(H2S)
B.反应S2-+H2O![]() HS-+OH-的平衡常数K=1×10-7
HS-+OH-的平衡常数K=1×10-7
C.0.1 mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.NaHS与Na2S以任意比混合的溶液中:c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
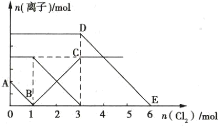
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
查看答案和解析>>
科目: 来源: 题型:
【题目】根据合成氨反应的能量变化示意图,下列有关说法正确的是( )
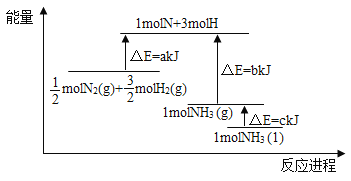
A. 若合成氨反应使用催化剂,反应放出的热量增多
B. 断裂0.5moIN2(g)和1.5molH2(g)中所有的化学键释放akJ热量
C. 2NH3(l)= N2(g)+3H2(g) △H=2(b+c-a) kJ/mol
D. N2(g)+3H2(g)=2NH3(g) △H=-2(a-b)kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】Persi等人以LiTi2O4作负极,LiFePO4作正极,采用LiClO4-EC-PC-PVdF凝胶作电解质溶液,组成新型锂离子二次电池,电池隔板只允许Li+通过,该锂离子二次电池的结构示意图如图,下列说法不正确的是
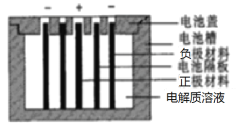
A.若正、负极材料质量相等,当外电路转移1 mol e-时,两极质量差为14g
B.放电时,LiFePO4电极的电势低于LiTi2O4的电势
C.放电时,电解质溶液中的Li+向LiFePO4一极移动
D.充电时,LiFePO4电极接电源的正极,发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
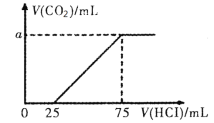
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
查看答案和解析>>
科目: 来源: 题型:
【题目】利用废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)制备纳米Fe3O4及副产物ZnO的流程如下:
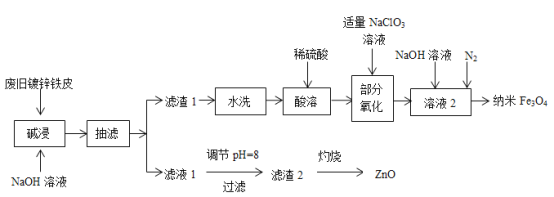
已知:Zn及其化合物的性质与Al及其化合物的性质相似,“滤液1”中锌元素以ZnO22-形式存在。回答下列问题:
(1)实验中需调节“滤液1”的pH约为8,pH过大或过小都不利的原因是_______________。
(2)“滤渣1”的主要成分是__________(填化学式,下同),“滤渣2”的主要成分是_______。
(3)“部分氧化”阶段,ClO3-被还原为Cl-,该反应的离子方程式是____________________。
(4)向“溶液2”中通入N2的目的是________________________________________________。
(5)某化学兴趣小组用m1 g废旧镀锌铁皮(Fe元素的质量分数为w)制备纳米Fe3O4,最终得到m2 g产品,则产率为__________(用含m1、m2和w的代数式表示)。
(6)用酸性高锰酸钾溶液可测定产物Fe3O4中二价铁含量,用稀硫酸溶解Fe3O4,再用酸性KMnO4标准溶液进行滴定,发生反应:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。
①判断该反应到达滴定终点的现象是______________________________________________。
②滴定操作中,若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,则测得的二价铁含量__________(填“偏高”偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

下列说法不正确的是( )
A. 通过计算,可知系统(Ⅰ)制备氢气的热化学方程式为:H2O(l)= H2(g)+1/2O2(g) ΔH = 286 kJ· mol-1
B. 通过计算,可知系统(Ⅱ)制备氢气的热化学方程式为:H2S(g)=H2(g)+S(s) ΔH =20kJ·mol-1
C. 若反应H2(g)+1/2O2(g)=H2O(g) ΔH = -a kJ · mol-1 , 则a>286
D. 制得等量H2所需能量较少的是热化学硫碘循环硫化氢分解法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com