
科目: 来源: 题型:
【题目】实验室欲用氢氧化钠固体配制1.0mol·L-1的氢氧化钠溶液240mL:
(1)配制溶液时,必须用到的玻璃仪器有烧杯、胶头滴管、____________。
(2)计算实验需要称量氢氧化钠的质量为:___________ g
(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:
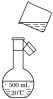
①________________________________________________________________________;
②________________________________________________________________________。
(5)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是______(填字母)。
A.所用氢氧化钠已经潮解
B.向容量瓶中加水未到刻度线
C.有少量氢氧化钠溶液残留在烧杯里
查看答案和解析>>
科目: 来源: 题型:
【题目】金属铋在自然界中的量极少,用途非常广泛,通常以辉铋矿为原料提取金属铋,工艺流程如图所示:
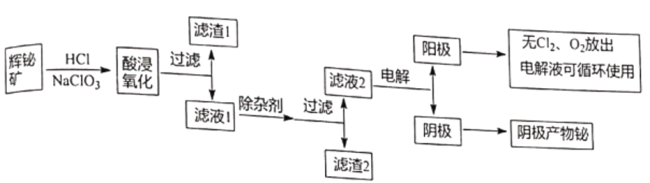
已知:①辉铋矿主要成分是Bi2S3,还含少量Bi2O3、SiO2、铁的氧化物和硫化物等。
②Bi2O3能溶于酸,NaBiO3不溶于水。
③常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Bi (OH)3]=4×10-30;Ksp[Fe(OH)2]=8.0×10-16;
回答下列问题:
(1)写出酸浸氧化时Bi2S3被氧化成硫单质的化学方程式_______________。
(2)滤渣1的成分为_______________。
(3)除杂剂的作用a.调节溶液pH,b_______________,写出一种能提高产物产量的除杂剂_______________。
(4)滤液2还可用来制备NaBiO3,可向滤液2中加入NaOH和NaClO溶液制取NaBiO3,写出该反应的离子方程式_______________。
(5)滤液2采用电解法制取金属铋单质,阳极产物处理后可继续循环使用,电解装置如图所示。
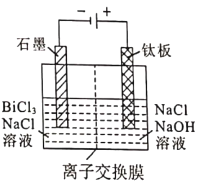
①交换膜类型为_______________(填“Cl-”或“OH-”)交换膜。
②阳极电极反应式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品——NH4Cl和Na2CO3。回答相关问题:
(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:

(1)启普发生器中发生的离子反应方程式为___,如果上述装置中导管被堵塞,启普发生器中观察到的现象是___。
(2)仪器3中盛装的试剂是___;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为___。
(3)观察仪器4中CO2流速的方法是___,仪器5中试剂的作用是___。
(4)反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是___。
(Na2CO3的制备)
(5)将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全___。
(NH4Cl的制备)
(6)向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是___,过滤NH4Cl晶体后的滤液可以再次循环使用。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
CH3OH(g),CO在不同温度下的平衡转化率与压强及温度的关系如图所示。下列说法正确的是( )
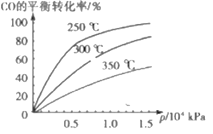
A.该反应的△H>0
B.实际生产选择的压强越高越好
C.使用合适的催化剂,可以降低反应的活化能,提高CO的转化率
D.平衡常数:K350℃<K250℃
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是学生课外实践活动的实验设计,其中不能达到们应的实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 除去乙酸乙酯中的乙酸 |
|
B | 证明氧化性:Cl2>I2 |
|
C | 用NaOH标准溶液滴定某稀盐酸 |
|
D | 探究锅炉里的水垢样品在酸中的溶解 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是
A | B | C | D | |
研究目的 | 温度(T)对反应的影响(T2>T1) | 压强(p)对平衡常数的影响 | 温度(T)对反应的影响 | 压强(p)对反应的影响(p2>p1) |
图示 |
|
|
|
|
A.AB.B .C.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。
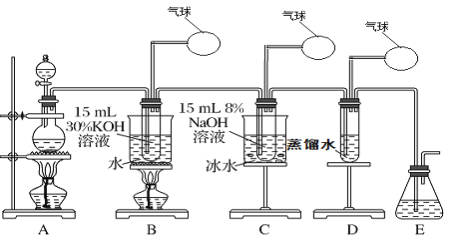
实验Ⅰ.制取氯酸钾(KClO3)、次氯酸钠、氯水
(1)写出装置A实验室制取Cl2的化学反应方程式_________________________
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、________、________。
(3)写出B中制备氯酸钾(KClO3)的方程式____________________
(4)装置C中反应需要在冰水浴中进行,其原因是_____________________________
资料:SO2是一种酸性氧化物,与CO2相似,2NaOH(过量)+SO2=Na2SO3+H2O ,SO32-是还原性很强的离子,在溶液中与氧化性强的离子不能大量共存,易被氧化成SO42—。
实验Ⅱ.尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和![]()
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)。
①提出合理假设:
假设1:只存在![]() ;
;
假设2:既不存在![]() 也不存在ClO-;
也不存在ClO-;
假设3:______________________________。
②设计实验方案,进行实验。请在表中写出实验步骤以及预期现象和结论。
限选实验试剂:3mol·L-1 H2SO4、1mol·L-1 NaOH溶液、0.01mol·L-1酸性KMnO4溶液、淀粉、KI溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
步骤3:____________________________________ | __________________________________ |
查看答案和解析>>
科目: 来源: 题型:
【题目】在一固定容积的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)![]() CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示,则下列说法正确的是( )

A.在T2时,若反应体系处于状态D,则此时v(正)<v(逆)
B.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C.若状态B、C、D的压强分别为PB、PC、PD,则PC>PD=PB
D.该反应的△H>0
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是________(填字母)。
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是(_______)
A. NaNO2被氧化 B. 药品美蓝是还原剂
C. NaNO2是还原剂 D. 药品美蓝被还原
(3)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________。
Ⅱ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(4)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中Na2O2是________(填“氧化剂”或“还原剂”)。
(5)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、![]() 、Cl-、H2O。
、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3∶2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:__________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一个密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) 。已知反应过程中某一时刻,SO2、O2、SO3分别是2mol/L、1mol/L、2mol/L,当反应达到平衡时,可能存在的数据是( )
2SO3(g) 。已知反应过程中某一时刻,SO2、O2、SO3分别是2mol/L、1mol/L、2mol/L,当反应达到平衡时,可能存在的数据是( )
A.SO2为4mol/L,O2为2mol/LB.SO2为2.5mol/L
C.SO2、SO3均为1.5mol/LD.SO3为4mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com