
科目: 来源: 题型:
【题目】物质的量是化学中常用的物理量,请完成以下有关计算:
(1)0.2 g H2含有________个H原子。
(2)标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)100 mL硫酸钠溶液中n(Na+)=0.20 mol,则其中c(SO42-)=________。
(4)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为________。
(5)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列选项中的原因或结论与现象不对应的是( )
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL0.010mol·L-1KSCN溶液,溶液呈红色,再滴加1ml1 mol·L-1KCl溶液,溶液颜色变浅 | 增大生成物浓度,平衡向逆反应方向移动 |
C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
D | 在密闭容器中有反应:A+xB(g) | 若A为气体、x>1 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___附近,理由是________。推广使用无铅汽油的优点是____________。

(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+![]() O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______(用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g) ![]() 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____0,p1 ____ p2(填“>”或“<”)。
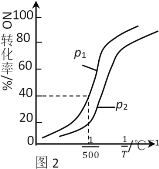
②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4H2O![]() +OH-,则
+OH-,则![]() 的电子式为________________。
的电子式为________________。
②已知:Ag+(aq) +2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为Kf =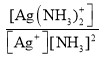 =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:![]() ≈3.16)。
≈3.16)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁和铝的合金投入100 mL,一定物质的量浓度的盐酸中,恰好反应,共产生气体5.6 L(标准状况下),向所得溶液中滴加5mol·L-1NaOH溶液至过量,最终产生白色沉淀13.6 g。请计算:
(1)原合金中镁和铝的质量分别是________。
(2)原盐酸溶液的物质的量浓度________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关(科学探究)为基础,设计了如图实验装置并记录相关实验数据。
(实验装置)
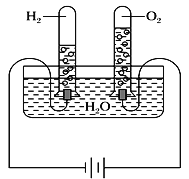
(部分实验数据)
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)在该实验条件下,3 mol O2的气体的体积为____________L
查看答案和解析>>
科目: 来源: 题型:
【题目】有一含NaCl、NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。请回答下列问题。

(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,A中碱石灰的作用是_______。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_______。
⑤打开活塞K1,缓缓鼓入空气数分钟,拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)实验方案的评价及数据处理
①实验步骤⑤打开活塞K1,缓缓鼓入空气数分钟的目的是__________。
②若样品质量为W g,反应后C装置增加的质量为m1 g则D装置增重的质量为______g(用含m1的代数式表达),混合物中NaHCO3的质量分数为________(用含W、m1的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钛、镍、铅单质及其化合物在工业生产中有广泛的应用。回答下列问题:
(1)Ti3+的价电子排布式为____,Ti3+的还原性常用于钛含量的测定。将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,该反应的离子方程式为_____,然后以NH4SCN溶液作指示剂,用FeCl3标准溶液滴定。可见,Fe3+先与____反应(填“Ti3+”或“SCN-”)。
(2)已知:
物质 | 性 质 |
TiC | 质硬,熔点:3140℃,沸点:4820℃ |
TiCl4 | 熔点:-25℃,沸点:136.4℃,具有挥发性 |
TiC的熔沸点明显高于TiCl4的原因为______________。
(3)乙二胺四乙酸(俗名EDTA)结构如图,

是代表性的螯合剂,分子中可作为配位原子的是________(填元素符号,下同),第一电离能最大的元素是_________。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)] 治疗铅中毒,其离子方程式为_______________。
(4)图甲是LaNi5晶体示意图,该结构由两种不同的原子层组成,第一层![]() 填入由
填入由![]() 组成的正三角形空穴中心,第二层完全由
组成的正三角形空穴中心,第二层完全由![]() 组成,具有平面六方对称性,原子数目等于第一层的
组成,具有平面六方对称性,原子数目等于第一层的![]() 和
和![]() 数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中
数目的总和,这两层交替排列形成LaNi5晶体。图乙是LaNi5的六方晶胞,图乙中![]() 代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(
代表____(填“La”或“Ni”)原子。该LaNi5晶体的密度为_______gcm-3(列出计算式。NA为阿伏加德罗常数的值,LaNi5摩尔质量为M gmol-1)。图乙晶胞中原子坐标参数A为(0,0,0),B为(![]() ,
,![]() ,
,![]() ),则C点的原子坐标参数为__________。
),则C点的原子坐标参数为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
①向50mL小烧杯中加入20mL饱和FeCl3溶液并加热煮沸,制备氢氧化铁胶体
②家庭的厨卫管道内常因留有油脂、毛发、菜渣、纸棉纤维等而造成堵塞,此时可用固体管道疏通剂疏通,其主要成分为铝和氢氧化钠
③打印机(或复印机)使用的墨粉中的铁的氧化物是氧化铁
④“绿色化学”就是在生产结束后及时治理污染
⑤食品中适量添加二氧化硫可以达到去色、杀菌、抗氧化的作用
⑥对于可逆反应2HI(g)![]() H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
H2(g) +I2(g) ΔH<0,若将反应体系降温至室温,反应正向移动,可以从温度分析对该平衡的影响
A.②⑤⑥B.①③⑥C.②⑤D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】硝酸被称为“国防化工之母”,某化学兴趣小组对浓硝酸与铜片的反应进行探究,请完成下列问题。
(1)写出反应刚开始阶段化学方程式,并用“双线”桥表达电子转移的方向和数目______________,该阶段反应现象为_________。
(2)最终铜有剩余,则反应将要结束时的离子方程式是________;待反应停止时,再加入稀硫酸,这时铜片上又有气泡产生,其原因是_______。
(3)用试管将反应产生的NO2收集满并倒立在足量的水中,待试管中液面不再上升时,试管中剩余气体的体积约为原气体体积的________(相同条件下)
(4)若12.8g铜与一定质量的浓硝酸反应,铜完全溶解时,产生NO和NO2混合气体共5.6L(标准状况),则反应中转移的电子的物质的量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com