
科目: 来源: 题型:
【题目】食品保鲜膜按材质分别为聚乙烯 (PE )、聚氯乙烯 (PVC )、聚偏二氯乙烯 (PVDC )等种类。 其中 PE 和 PVDC 是安全的。PVC 对人体的潜在危害主要来源于两个方面:产品中氯乙烯单体残留量、加工过程中使用的加工助剂的种类及含量。
(1)写出用乙烯、氯乙烯分别生产聚乙烯和聚氯乙烯的化学方程式:乙烯→聚乙烯 (PE ):_____ 氯乙烯→聚氯乙烯 (PVC ):_____ 日常用的食品保鲜膜宜选用_____。
(2)目前出现的“不粘锅”、不粘油的吸油烟机等新型厨具,其秘密就是表面有一种叫做“特富龙”的涂层,实际上就是被称为“塑料王”的聚四氟乙烯。它的单体四氟乙烯的结构简式是_____,合成特富龙的反应类型是_____,反应方程式为_____。
(3)聚四氟乙烯的发现源于一次实验意外。1938 年,化学家普鲁凯特与助手们研究四氟乙烯的聚合反应,他们将四氟乙烯贮存在冷藏箱中的加压钢瓶中,当将钢瓶与反应器管道、反应器 (管道 及反应器间隙有空气 )接通后,发生故障,四氟乙烯气体并没有通到反应器中,经称重证明钢瓶中气体一点没减少,打开阀门也没有四氟乙烯气体逸出,但拆卸阀门后却从钢瓶倒出与四氟乙烯等重的白色粉末,即四氟乙烯已在钢瓶中发生了聚合反应。后经确证,该白色粉末就是聚四氟乙烯。1945 年,美国杜邦公司开始在工业规模上生产聚四氟乙烯,由此可以推知该反应的条件是_____、_____、_____引发。
(4 )不粘锅的内壁有一薄层聚四氟乙烯涂层,因此用不粘锅烧饭菜时不易粘锅,下列说法正确的是_____
a.聚四氟乙烯分子中没有双键
b.聚四氟乙烯的单体是不饱和烃
c.聚四氟乙烯的化学性质很不活泼
d.聚四氟乙烯的熔沸点很低
乙炔是一种重要的基本有机原料,在一定条件下其衍变关系如图:

已知:B 是一种塑料,75%的 D 溶液在医药上用作消毒剂。试回答下列问题:
(5)比乙炔多一个碳原子的同系物的结构简式是_____。
(6)A 物质的结构简式是_____,A→B 反应类型是_____反应。
(7)出以下各步反应的化学方程式:乙炔→A:_____ 乙炔→C:_____ C→D:_____
查看答案和解析>>
科目: 来源: 题型:
【题目】烷、烯、炔都是常见的碳氢化合物。
(1)写出下列有机物的系统命名法名称:
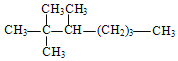 名称是_____
名称是_____
(2)有下列有机物:①CH3CH3 ②CH2=CH2 ③CH3﹣CH2﹣C≡CH ④CH3﹣C≡ C﹣CH3 ⑤C6H12 ⑥CH3﹣CH=CH2,其中互为同系物的是_____,互为同分异构体的是_____ (填编号)
(3)实验室常用浓硫酸和乙醇混合加热制取乙烯。
①实验室制乙烯的化学方程式为_____。
②关于该实验的说法中正确的是_____
a.浓硫酸只有催化剂的作用
b.可用向下排空气法收集乙烯
c.在反应容器中放入几片碎瓷片防止混合液暴沸
d.温度计应插入反应溶液液面下,以便控制温度
(3)实验后期制得的乙烯气体中常含有杂质气体 SO2和CO2,将此混合气体直接通入溴水中,若 观察到溴水褪色,能否证明乙烯发生了加成反应?_____(填“能”或“否”),原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲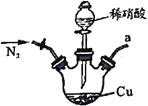 乙
乙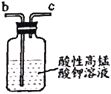 丙
丙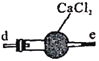 丁
丁![]()
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
A.甲中滴入稀硝酸前需通人N2
B.仪器的连接顺序为a-f-g-d-e-b
C.丙中CaCl2用于干燥NO
D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外活动小组以海带为原料获得少量碘水,并以四氯化碳(沸点76.80C)为溶剂将碘从碘水中提取出来,具体过程如图所示。

请回答下列问题:
(1)操作①的名称为________________、_________________;
(2)向含碘单质的水溶液中加入CCl4振荡、静置后,观察到的现象是______________________;
(3)操作③中,将含碘单质的水溶液与CCl4在分液漏斗中混合、振荡摇匀放在铁架台的铁圈上,分液漏斗的下端尖嘴处紧贴在承接的烧杯内壁上静置后,下面的操作步骤是_______________________。
(4)从含碘的有机溶剂中经过蒸馏可以提取碘和回收有机溶剂,该实验需要的主要玻璃仪器除酒精灯、烧杯、温度计、锥形瓶、牛角管外,还需要____________________,实验中温度计水银球所处位置为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
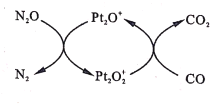
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】对相同物质的量的乙烯和丙烯,有下列叙述:①碳原子数之比为 2:3②氢原子数之比为 2:3③含碳的质量分数相同④分子个数之比为 1:1.其中正确的是 ( )
A.①④B.①②④C.①②③D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】无水溴化镁常常做催化剂。选用如图所示装置(夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
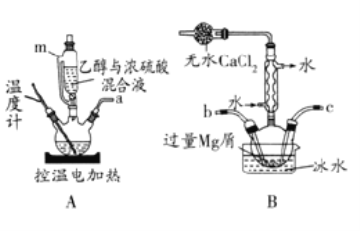
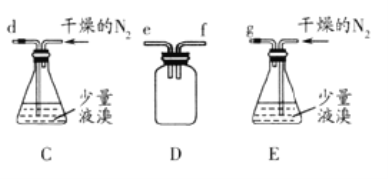
已知:
(1)乙醚的熔点为34.6℃,沸点为132℃。
(2)Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应MgBr2+3C2H5OC2H5→MgBr23C2H5OC2H5。
实验主要步骤如下:
Ⅰ.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
Ⅱ.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
Ⅲ.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水MgBr2。回答下列问题:
(1)步骤I中所选装置的正确连接顺序是a___(填小写字母)。装置D的作用是___。
(2)装置A中使用仪器m的优点是___。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是___。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是___。
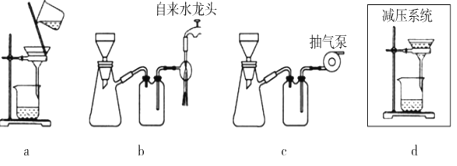
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是___(填序号)。
(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请说明原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一容积为2 L的密闭容器内加入0.2 mol N2和0.6 mol H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:
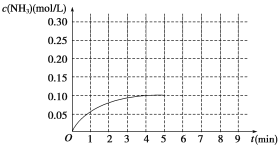
(1)根据图示,计算从反应开始到第4分钟达到平衡时,平均反应速率υ(N2)为__________。
(2)达到平衡后,第5分钟末,若保持其它条件不变,只改变反应温度,则NH3的物质的量浓度不可能为_____________。
a.0.20 mol/L b.0.12 mol/L c.0.10 mol/L d.0.08 mol/L
(3)达到平衡后,第5分钟末,若保持其它条件不变,只把容器的体积缩小,新平衡时NH3的浓度恰好为原来的2倍,则新体积_____(选填“大于”、“等于”、“小于”)二分之一倍的原体积,化学平衡常数________(选填“增大”、“减小”或“不变”)。
(4)在第5分钟末将容器的体积缩小一半,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在图中画出第5分钟末到达新平衡时NH3浓度的变化曲线_____。
(5)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是五种短周期元素的原子序数与其在氢化物中化合价的关系图,则下列说法不正确的是( )
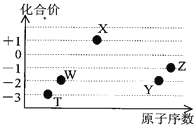
A.X的氢化物具有很强的还原性
B.YW2、ZW2、X2W2都能使品红溶液褪色,且褪色原理相同
C.Y、Z元素的最高价氧化物对应的水化物都呈酸性,而且酸性:HZO4 > H2YO4
D.元素W、T的氢化物的沸点比同主族中相邻的氢化物高,是因为这两种氢化物分子间存在氢键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com