
科目: 来源: 题型:
【题目】我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了可控结构单壁碳纳米管的制备难题。海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源,含有钨、铁、锰、锌、钴等。
(1)基态铬原子的核外未成对电子数为________。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为________。
(2)纳米结构氧化钴可在室温下将甲硫醛![]() 完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中
完全催化氧化,甲硫醛分子的中心原子的VSEPR构型为________,其分子中![]() 键与
键与![]() 键的个数比为________。
键的个数比为________。
(3)六羰基钨![]() 的熔点为
的熔点为![]() ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种组成元素的第一电离能由小到大的顺序为________![]() 填元素符号
填元素符号![]() 。配体CO中与W形成配位键的原子是C非O,原因是________________________。
。配体CO中与W形成配位键的原子是C非O,原因是________________________。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”。下列分子中存在“离域
键”。下列分子中存在“离域![]() 键”的有________
键”的有________![]() 填字母
填字母![]() 。
。
A.环己烷 ![]() 二氧化硫
二氧化硫 ![]() 三氟化氮
三氟化氮 ![]() 苯酚
苯酚
(5)![]() 、
、![]() 能与
能与![]() 络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
络合形成络离子,其结构如图1所示。该络离子与钾离子可形成华蓝钾盐,该钾盐的化学式为________。
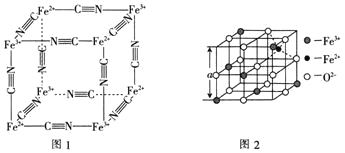
(6)图2是从铁氧体离子晶体![]() 中取出的能体现其晶体结构的一个立方体。已知
中取出的能体现其晶体结构的一个立方体。已知![]() 晶体的密度为
晶体的密度为![]() ,则图2中
,则图2中![]() ________
________![]() 已知
已知![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组用如图装置进行SO2与FeCl3溶液反应的相关实验:
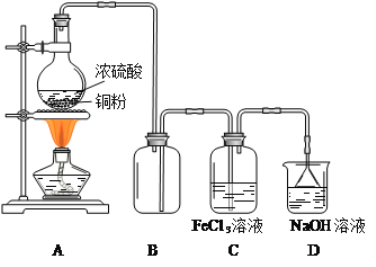
完成下列填空
(1)在配制FeCl3溶液时,需先把FeCl3晶体溶解在________中,再加水稀释,才能得到透明澄清溶液。
(2)B装置的作用是__________;D装置中吸收尾气的离子方程式是__________。
(3)A装置中制备SO2的化学方程式为:_______,在该反应中浓硫酸体现的性质是______。
(4)当温度较高的SO2气体(足量)通入FeCl3溶液中时,可以观察到溶液由黄色逐渐变为浅绿色。根据此现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
a.写出SO2与FeCl3溶液反应的离子方程式:___________。
b.请设计实验方案检验上述反应中FeCl3是否反应完全:_________________。
c.若向得到的浅绿色溶液中逐滴滴加NaOH溶液,可以观察到的现象是:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
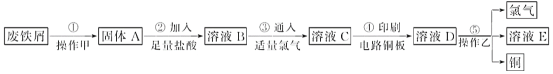
请回答下列问题:
(1)若溶液B中只含有Fe2+而不含Fe3+,可证明该事实的实验方法是________(填序号)。
A.先加氯水,后加KSCN溶液后显红色
B.先加KSCN溶液,不显红色,再加氯水后显红色
C.④只滴加KSCN溶液不显红色
(2)步骤④的化学方程式为_____________________________。
(3)若除去氯化亚铁中氯化铁可以加入试剂________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,SO2和O2发生反应:2SO2(g)+O2(g)=== 2SO3(g),SO2的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
SO2/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A.v(SO2)=0.032 mol·L-1B.v(SO2)=0.050 mol·L-1
C.v(SO2)=0.050 mol·L-1·s-1D.v(SO2)=0.032 mol·L-1·s-1
查看答案和解析>>
科目: 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1)![]() 原子基态时外围电子轨道表示式为______;
原子基态时外围电子轨道表示式为______;
(2)由A、B、C形成的离子![]() 与
与![]() 互为等电子体,则
互为等电子体,则![]() 的结构式为______;
的结构式为______;
(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大![]() 键表示为
键表示为![]()
①下列微粒中存在“离域![]() 键”的是______;
键”的是______;
![]()
![]()
②![]() 分子中大
分子中大![]() 键可以表示为______;
键可以表示为______;
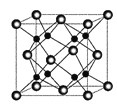
(4)![]() 和D能够形成化合物X,其晶胞结构如图所示,晶胞参数
和D能够形成化合物X,其晶胞结构如图所示,晶胞参数![]() ,晶胞中C原子的配位数为______;列式计算晶体X的密度______
,晶胞中C原子的配位数为______;列式计算晶体X的密度______![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中,错误的是( )
A.摩尔是物质的量的单位
B.36g水中含氢原子数目为4NA(NA表示阿伏加德罗常数的值)
C.在0.5molNa2SO4中,含有的Na+数约是6.02×1023
D.等质量的O2与O3,所含氧原子数之比为3:2
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图回答(装置用代号表示)

①实验室制用高锰酸钾制氧气时,应选用的发生装置是_____;制氢气时应选用的发生装置是_____,制二氧化碳时应选用的发生装置是_____,检验二氧化碳气体可选用D装置,其装置中盛放的试剂一般是_______。
②用锌粒和浓盐酸反应制氢气,将制成的气体通入硝酸银,有白色沉淀,说明氢气中含有(写化学式)_____,反应方程式为______,若要制出纯净的氢气,除发生装置外还应选用的一种装置是_____;该装置中药品的作用是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度和体积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
2HI(g) (无色)达平衡状态,该状态下,说法不正确的是( )
A. 可逆反应停止 B. I2浓度不再变化
C. HI浓度不再变化 D. 混合气体颜色不再变化
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下三氯化氮( NCl3)是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3的说法正确的是
A.分子中N—Cl键是非极性键
B.分子中不存在孤电子对
C.NCl3分子是极性分子
D.因N—Cl键的键能大,它的沸点高
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下列科普短文,回答问题。
国家卫健委公布的《新型冠状病毒肺炎诊疗方案(试行》中提到:在相对封闭环境中,长时间暴露于高浓度气溶胶情况下,新冠病毒存在经气溶胶传播的可能。佩戴医用外科口罩可起到防护作用,含有病毒的飞沫会被口罩中间层熔喷无纺布(主要材质是聚丙烯)吸附。消毒也是控制病毒传播的有效措施,《新型冠状病毒肺炎流行期间预防性消毒指引》建议:表面消毒可选择含氯消毒剂、__%酒精,食饮具需要煮沸消毒15分钟以上。
(1)气溶胶中粒子的大小为_______.
a.< lnm b.> 100nm c.1nm~100nm
(2)丙烯在催化剂条件下制备聚丙烯,化学反应方程式为_______________
(3) 75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为__________。
(4)食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了______。
(5)环氧乙烷是一种低温灭菌剂, 经典的生产方法是氯代乙醇法,包括两步反应:
i.CH2=CH2+Cl2+H2O →ClCH2CH2OH+HCl
ii.ClCH2CH2OH+ HCl+Ca(OH)2 → ![]() + CaCl2 +2H2O
+ CaCl2 +2H2O
现代石油化工采用低温催化法: 2CH2=CH2+O2![]()
![]()
与氯代乙醇法相比,低温催化法的优点有________、_________. ( 答两点)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com