
科目: 来源: 题型:
【题目】利用下列装置分别完成相关实验,能达到实验目的是![]()
A | B | C | D |
制备并收集氨气 | 比较 | 用NaOH溶液滴定锥形瓶中的盐酸溶液 | 制备乙酸乙酯 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:
(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。
(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。
某化学活动小组用下图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
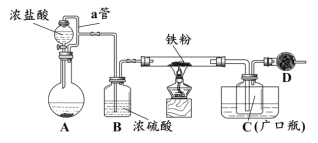
(1)在装置A中,用KMnO4与浓盐酸反应制取氯气,反应的离子方程式为_________。仪器D的名称是__________________。
(2)D中装的药品是碱石灰,其作用是__________________________。
(3)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_____(只能选取一种试剂,填序号)进行检测,实验现象是__________________________________。
①H2O2 溶液 ②KI-淀粉溶液 ③KSCN溶液 ④酸性KMnO4溶液
(4)定量分析。取装置C中的产物,按以下步骤进行测定:①称取4.60g产品溶于过量的稀盐酸中;②加入足量H2O2溶液;③再加入足量NaOH溶液;④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。
则该样品中铁元素的质量分数为_______%(结果精确到小数点后两位)。
(5)由(4)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量______(填“相等”、“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氯化铁,可采取的“装置”改进措施是_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2g/mL,质量分数为36.5%的浓盐酸配制250mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为__mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、__、__。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是__。
A.量取浓盐酸时俯视刻度线
B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线
D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,将0.10mol·L-1的盐酸滴入20.00mL0.10mol·L-1氨水中,溶液的pH和pOH随加入盐酸体积的变化曲线如图所示。已知pOH=-lgc(OH-)。下列说法不正确的是( )
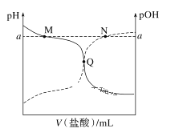
A.M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B.N点所示溶液中c(NH4+)<c(Cl-)
C.Q点消耗盐酸的体积小于氨水的体积
D.M点和N点水的电离程度均小于Q点
查看答案和解析>>
科目: 来源: 题型:
【题目】常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。已知d点所示的溶液中,钠元素与氯元素的物质的量相等,下列选项正确的是( )
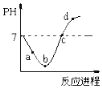
A.a点时,已经滴入NaOH溶液
B.b点所示的溶液中,只存在两种分子
C.a、b、c、d四个点当中,d点水的电离程度最大
D.c点所示的溶液中,c(Na+)=c(Cl-)+c(HClO)
查看答案和解析>>
科目: 来源: 题型:
【题目】燃煤尾气气和汽车尾是造成空气污染的主要原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)和时间(t)的变化曲线如图所示。
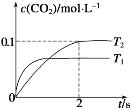
据此判断:
①在T2温度下,0~2 s内的反应速率v(N2)=_______mol /(L·s)。
②该反应的ΔH__________0(选填“>”或“<”)。
(2)煤燃烧产生的烟气中有含氮的氧化物NOx,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+4NO(g)2N2(g)+CO2(g)+2H2O(g) ΔH<0
CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g) ΔH<0
①若在恒压下,将CH4(g)和NO2(g)置于密闭容器中,发生上述反应。提高NO2转化率的措施有____。
A.加入催化剂 B.降低温度 C.减小投料比[![]() ] D.增大压强
] D.增大压强
②在容积相同的两个密闭容器内(装有等量的某种催化剂)先各通入等量的CH4,然后再分别充入等物质的量的NO和NO2。在不同温度下,同时分别发生上述的两个反应,并在t秒时测定其中NOx转化率,绘得图像如图所示:
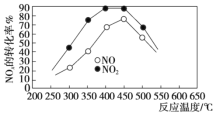
从图中可以得出的结论是:
结论一:在250~450 ℃时,NOx转化率随温度升高而增大,450~600 ℃时NOx转化率随温度升高而减小。推测原因是_____________。
结论二:______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生产生活有密切的联系。下列关于化学物质应用的说法错误的是![]()
A.84消毒液和洁厕灵不能混合使用
B.![]() 可作葡萄酒的防腐剂
可作葡萄酒的防腐剂
C.醋酸可用于除水垢是由于碳酸的酸性比醋酸强
D.![]() 过硫酸氢钾
过硫酸氢钾![]() 可用于游泳的杀菌消毒是由于它能使蛋白质变性
可用于游泳的杀菌消毒是由于它能使蛋白质变性![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子浓度在指定溶液中一定能大量共存的是![]()
![]() 加入铝能放出
加入铝能放出![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
![]()
![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
![]() 由水电离出的
由水电离出的![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
![]() 能使淀粉碘化钾试纸显蓝色的溶液:
能使淀粉碘化钾试纸显蓝色的溶液:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
![]() 使甲基橙变红的溶液中:
使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
A.③④B.②④C.②⑤D.①⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+2B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、2molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | v甲 | v乙 | v丙 |
下列说法正确的是( )
A.v甲=v丙B.c乙<c丙C.a甲 +a乙<1D.K乙
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g)+3N(g)![]() xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
xQ(g)+3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是
A. x值为2 B. 混合气体的密度增大
C. N的转化率为80% D. 混合气体平均摩尔质量不变,不能说明该反应达平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com