
科目: 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是( )
A. 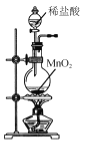 制取Cl2
制取Cl2
B. 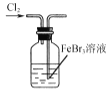 使Br-转化为Br2
使Br-转化为Br2
C.  分液,先放出水层,再倒出溴的苯溶液
分液,先放出水层,再倒出溴的苯溶液
D.  将分液后的水层蒸干获得无水FeCl3
将分液后的水层蒸干获得无水FeCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的名称为3-甲基丁烷
的名称为3-甲基丁烷
B. 淀粉和纤维素的化学式均为(C6H10O5)n,故两者互为同分异构体
C. ![]() 和
和![]() 为同一种物质
为同一种物质
D. HCOOH与OHCCH2OH属于同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上以黄铜矿为原料,采用火法治铜。其中间过程的一个反应的化学方程式为2Cu2O+Cu2S![]() 6Cu+SO2↑,对于该反应下列说法正确的是
6Cu+SO2↑,对于该反应下列说法正确的是
A.氧化产物是Cu
B.还原剂是![]()
C.生成1molCu转移的电子数为2mol
D.![]() 既是氧化剂也是还原剂
既是氧化剂也是还原剂
查看答案和解析>>
科目: 来源: 题型:
【题目】以镍废料(主要成分为镍铁合金,含少量铜)为原料,生产NiO的部分工艺流程如下:
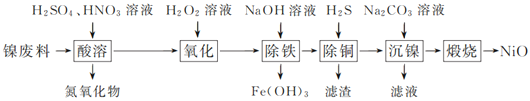
已知:下表列出了几种金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
Ni2+ | Fe2+ | Fe3+ | Cu3+ | |
开始沉淀pH | 6.2 | 7.6 | 2.3 | 4.2 |
沉淀完全pH | 8.5 | 9.1 | 3.2 | 5.6 |
(1) “酸溶”时Ni转化为NiSO4,该过程中温度控制在70~80 ℃的原因是________________。
(2) “氧化”时,Fe2+参加反应的离子方程式为___________________________________。
(3) “除铁”时需控制溶液的pH范围为________。
(4) “滤渣”的主要成分为___________(填化学式)。
(5) “沉镍”时得到碱式碳酸镍[用xNiCO3·yNi(OH)2表示]沉淀。
①在隔绝空气条件下,“煅烧”碱式碳酸镍得到NiO,该反应的化学方程式为___________________。
②“沉镍”时,溶液pH增大,碱式碳酸镍中Ni元素含量会增加,原因是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”(NaClO含量为8~10%,另含少量NaCl)置于空气中会逐渐变质,同学们对其成分(水除外)作如下探究:
⑴查阅资料
①“84消毒液”有漂白性和碱性,呈碱性的原因是 ______ (用离子方程式解释)。
电离方程 | H2CO3 | HCO3- | HClO |
电离常数 | K1 =4.4×10-7 | K2 =4.7×10-11 | K =3×10-8 |
②化学上用电离常数衡量弱电解质的电离能力。
③常温下,Ca(ClO)2溶解度为21g;Cl2在饱和食盐水中的溶解度小。
⑵提出假设甲同学根据是否变质和变质情况作出如下假设:
假设一:只含NaCl、NaClO。
假设二:肯定含NaCl,可能含NaClO、NaHCO3、Na2CO3中至少一种,推测含NaHCO3的依据是 ______ (用方程式解释)。
假设三:只含NaCl。
⑶实验验证可选用药品:AgNO3溶液、稀硝酸、澄清石灰水、酚酞、CaCl2溶液
①甲同学取适量“84消毒液”样品于一支试管中,滴加澄清石灰水,出现白色沉淀,判定样品含Na2CO3。
乙同学认为甲的判断不准确,不能仅凭白色沉淀就确定含Na2CO3因为 ______(用离子方程式解释),为此乙同学在甲的基础上继续实验:另取少量样品,滴加CaCl2溶液,无白色沉淀。
②请你设计实验证明假设三不成立______。
③根据上述实验结果,该样品中一定含有______(填化学式)。
⑷定量检测
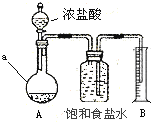
依据原理:2HCl(浓) + NaClO = NaCl + Cl2↑ + H2O,设计测定NaClO含量的实验如下:
取10g“84消毒液”样品,加足量Ca(OH)2至沉淀完全,过滤并洗涤沉淀,将滤液和洗涤液合并混匀后加入下图装置A中(加热装置已略去),然后加入浓盐酸,当不再有气体生成时,B中得到224 mL液体(折合到标准状况),a仪器的名称是______,实验测得原样品中NaClO的质量分数为 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(Ⅰ)(CH3)2NNH2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(g)
(Ⅱ)N2O4(g)2NO2(g)
(1)反应(Ⅰ)中氧化剂是___。
(2)当温度升高时,气体颜色变深,则反应(Ⅱ)为___(填“吸热”或“放热”)反应。
(3)若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=_______molL-1s-1。
(4)NO2可用氨水吸收生成NH4NO3。25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___(用离子方程式表示)。
(5)向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将___(填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为___mol·L-1。(NH3·H2O的电离平衡常数取Kb=2×10-5mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如图所示:
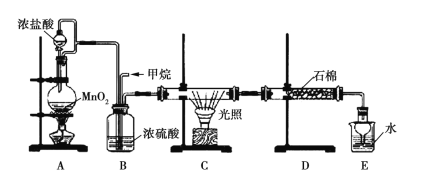
(1)A中制取Cl2的反应的化学方程式是_________________________。
(2)B装置的作用:①______;②______;③______。
(3)D装置中的石棉上吸附着潮湿的KI,其作用是________________。
(4)E装置的作用是_____(填序号)。
A.收集气体 B.吸收氯气 C.吸收氯化氢
(5)E装置中除了有盐酸生成外,还含有有机物,从E中分离出盐酸的最佳方法是______________。
(6)将1 mol CH4与Cl2发生取代反应,测得4种有机取代产物的物质的量相等,则消耗的氯气的物质的量是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+C(g)在3种不同条件下进行,B和C的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
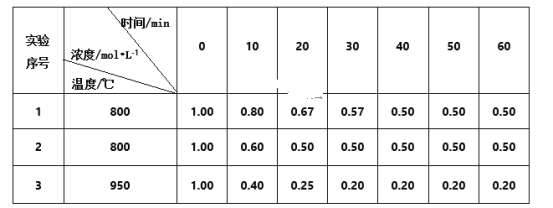
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为___mol·L-1·min-l,50min时,v正___v逆(填“<”“>”或“=”)。
(2)0~20min内,实验2比实验1的反应速率___(填“快”或“慢”),其原因可能是___。
(3)实验3比实验1的反应速率__(填“快”或“慢”),其原因是__。
查看答案和解析>>
科目: 来源: 题型:
【题目】完成下列填空。
(1)25℃时,已知 0.1mol·L-1 CH3COOH 溶液的 pH=3,其电离度为__,由水电离的c(H+)=__。
(2)相同 pH的 CH3COOH溶液和 HCl溶液加水稀释,其 pH变化情况如曲线I、II所示,其中表示 HCl溶液的是曲线__,a、b两点中,导电能力更强的是__。
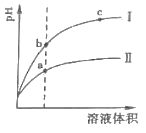
(3)氨水和盐酸等浓度等体积混合后,溶液呈酸性的原因是(用离子方程式表示)__。此时,该混合溶液中离子浓度由大到小的顺序为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电解质溶液的说法中错误的是( )
A.某温度下纯水中c(OH-)=2×10-7mol·L-1,则该温度下0.1mol·L-1的盐酸的pH=1
B.分别向同体积、同pH的醋酸和盐酸中加入足够的锌粉,两者产生H2的体积一样多
C.浓度相同的①Na2CO3、②Na2SO3、③Na2SO4三种溶液,pH由小到大的顺序是:③<②<①
D.室温下Ksp[R(OH)3]=1×10-38,在c(R3+)=0.01mol·L-1的溶液中,当pH=2时R3+开始沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com