
科目: 来源: 题型:
【题目】有甲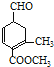 、乙
、乙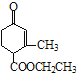 两种有机物,下列说法中不正确的是( )
两种有机物,下列说法中不正确的是( )
A.可用新制的氢氧化铜悬浊液区分这两种有机物
B.甲、乙互为同分异构体
C.甲在酸性和碱性条件下都能发生水解反应
D.等物质的量的甲、乙分别与足量NaOH溶液反应消耗NaOH的量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有关反应的能量变化如图,试回答下列问题。
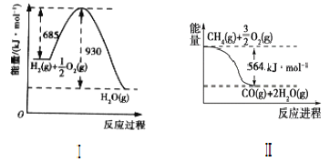
(1)根据图像,写出Ⅰ的热化学方程式:____。
(2)写出CH4(g)与H2O(g)反应制取CO(g)和H2(g)的热化学方程式:____。
(3)在(2)的反应中,相关的化学键键能数据如下表所示。判断H2O(g)中O—H的键能为___。
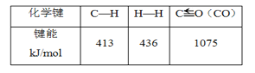
(4)试比较下列两组△H的大小(填“>”、“<”或“=”)
①C(s)+CO2(g)=2CO(g)△H1,C(s)+![]() O2(g)=CO(g)△H2则△H1___△H2。
O2(g)=CO(g)△H2则△H1___△H2。
②CH4(g)+H2O(g)=CO(g)+3H2(g)△H3,CH4(g)+H2O(l)=CO(g)+3H2(g)△H4,则△H3___△H4
③2H2(g)+O2(g)=2H2O(1)△H4,2H2(g)+O2(g)=2H2O(g)△H5,则△H4___△H5。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )
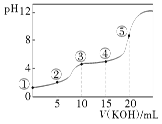
A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,现有![]() 的
的![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时某种微粒的浓度占各种微粒浓度之和的分数
平衡时某种微粒的浓度占各种微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法不正确的是
与pH的关系如图所示。下列说法不正确的是![]()
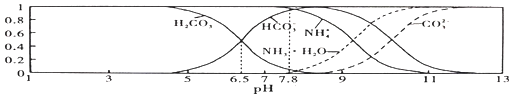
A.常温下![]()
B.向![]() 的上述溶液中逐滴滴加NaOH溶液时,
的上述溶液中逐滴滴加NaOH溶液时,![]() 和
和![]() 浓度都逐渐减小
浓度都逐渐减小
C.![]() 溶液中存在下列守恒关系:
溶液中存在下列守恒关系:![]()
D.当溶液的![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】【化学——选修3:物质结构与性质】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为__________________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为_________________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为___________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应过程中的离子方程式
为________________________;________________________。
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;
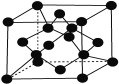
若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则该晶胞的体积为________ cm3 (用代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用0.10mol·L的氨水滴定l0.00mL0.05mol·L-1H2A溶液,加入氨水的体积(V)与溶液中lg![]() 的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
的关系如图所示(忽略溶液体积变化)。下列说法不正确的是
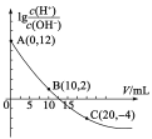
A.A点溶液的pH等于1
B.由图中数据可知,H2A为弱酸
C.B点水电离出的H+离子浓度为1.0×10-6mol·L-1
D.C点溶液中![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,下列说法正确的是( )
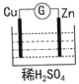
A.正极发生氧化反应
B.SO![]() 向负极移动
向负极移动
C.电子是由Zn片通过溶液流向Cu片
D.正极的电极反应式为Zn-2e-=Zn2+
查看答案和解析>>
科目: 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
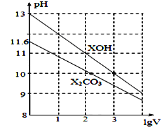
A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知CO32-的水解常数Kh1远远大于Kh2,则Kh1约为1.0×10-3.8
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目: 来源: 题型:
【题目】人体血液存在![]() 、
、![]() 等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值
等缓冲对。常温下,水溶液中各缓冲对的微粒浓度之比的对数值![]() 表示
表示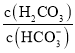 或
或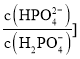 与pH的关系如图所示。已知碳酸
与pH的关系如图所示。已知碳酸![]() 、磷酸
、磷酸![]()
![]() 。则下列说法不正确的是( )
。则下列说法不正确的是( )
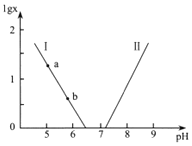
A.曲线Ⅱ表示 与pH的变化关系
与pH的变化关系
B.![]() 的过程中,水的电离程度逐渐增大
的过程中,水的电离程度逐渐增大
C.当![]()
![]() 时,
时,![]()
D.当pH增大时,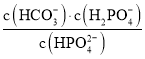 逐渐增大
逐渐增大
查看答案和解析>>
科目: 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com