
科目: 来源: 题型:
【题目】下列说法正确的是
A.装置可用于蒸干AlCl3饱和溶液制备AlCl3晶体
B.装置可测定中和反应反应热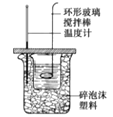
C.图丙装置可以探究温度对Na2S2O3溶液与H2SO4反应的影响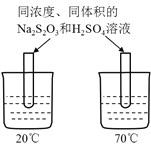
D.图丁装置可以论证醋酸、碳酸、硼酸的酸性强弱顺序为:醋酸>碳酸>硼酸
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列说法错误的是
A.石油、天然气和煤等化石能源都是一次能源
B.氢能是一种理想的绿色能源,现在的科学技术水平已经那个全面推广使用氢能
C.开发太阳能、水能、风能等新能源,减少使用有害物质对环境的污染
D.2CO(g)+O2(g) ![]() 2CO2(g) ΔH=-566kJ·mol-1 ,CO的燃烧热为283kJ·mol-1
2CO2(g) ΔH=-566kJ·mol-1 ,CO的燃烧热为283kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度(℃) | 10 | 20 | 30 | 50 | 70 |
pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 |
(1)甲同学认为,该溶液pH升高的原因是HCO3-的水解程度增大,碱性增强,该反应的离子方程式为____________________。
(2)乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________ (填“大于”或“小于”)NaHCO3的水解程度。
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液的pH,若pH______8.3(填“>”“<”或“=”,下同),说明甲同学正确;若_______8.3,说明乙同学正确。
查看答案和解析>>
科目: 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、下图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前后盛放盐酸的滴定管中液面的位置。

实验编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的读数(mL) | 滴定后盐酸的读数(mL) |
1 | 20.00 | 1.20 | 23.22 |
2 | 20.00 | 1.21 | 29.21 |
3 | 20.00 | 1.50 | 23.48 |
请回答下列问题:
(1)仪器A的名称是_________________。
(2)盐酸的体积读数:滴定前读数为___________,滴定后读数为_____________。
(3)某实验小组同学的三次实验的实验数据如上表所示。根据表中数据计算出待测NaOH溶液的平均溶度是____________mol/L(保留四位有效数字)。
(4)对下列几种假定情况进行讨论:
①取待测溶液的滴定管,放液前滴定管尖端有气泡,放液后气泡消失,对测定结果的影响是____________(填“无影响”“偏高”或“偏低”,下同)
②滴定前锥形瓶未用待测液润洗,对测定结果的影响是_______________;
Ⅱ、氧化还原滴定实验与酸碱中和滴定类似,原理是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0.001mol/L酸性KMnO4溶液滴定位置浓度的Na2SO3溶液,反应的离子方程式是2MnO4- + 5SO32- + 6H+=2Mn2+ + 5SO42- + 3H2O。请回答下列问题:
(1)该滴定实验所需仪器有________________。
A、酸式滴定管(50mL) B、碱式滴定管(50mL) C、量筒(10mL) D、锥形瓶 E、铁架台F、滴定管夹 G、烧杯 H、胶头滴管 I、漏斗
(2)实验时,应用_____________(填“酸式”或“碱式”,下同)滴定管盛放高锰酸钾溶液,应用__________滴定管盛放亚硫酸钠溶液。
(3)该实验_____________(填“需要”或“不需要”)加入指示剂,原因是_____________。滴定达到终点的标志是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)已知CH3OH(l)的燃烧热为726.51kJ/mol,CH3OH(l) + 1/2O2(g)=CO2(g) + 2H2O(g) ΔH=-a kJ/mol,则a______(填“>”“<”或“=”)726.51。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式___________________。
(3)火箭和导弹表面的薄层是耐高温的物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,反应的热化学方程式为:4Al(s) + 3TiO2(s) + 3C(s)=2Al2O3(s) + 3TiC(s) ΔH=-1176kJ/mol,则反应过程中,每转移1mol电子放出的热量为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应Ⅰ:CH4(g) + H2O(g)![]() CO(g) + 3H2(g),CH4的平衡转化率与温度、压强的关系如图所示:
CO(g) + 3H2(g),CH4的平衡转化率与温度、压强的关系如图所示:
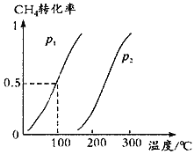
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为_________;
②100℃时平衡常数为______________,在其他条件不变的情况下升高温度,化学平衡常数将_________(“减小”“不变”或“增大”);
③图中的p1______(填“>”“<”或“=”)p2;
(2)在常温、压强为0.1MPa条件下,a molCO与3a mol H2的混合气体在催化剂作用下能自发发生反应Ⅱ:CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的ΔH_______(填“<”“>”或“=”,下同)0,ΔS________;
②若容器容积不变,下列措施可以提高CO转化率的是_________;
A、升高温度 B、将CH3OH(g)从体系中分离出来
C、再充入1molCO和3molH2 D、充入He,使体系总压强增大
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20.00mL 0.2000mol/L NH4Cl溶液中逐滴加入0.2000mol/L NaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法中正确的是( )

A.a点溶液中:c(H+) + c(NH4+) = c(OH-) + c(NH3·H2O)
B.b点溶液中:c(Cl-) = c(Na+) > c(H+) = c(OH-)
C.c点溶液中:c(NH3·H2O) + c(NH4+) = c(Cl-) + c(OH-)
D.d点溶液中:(Cl-) > c(NH3·H2O) > c(OH-) > c(NH4+)
查看答案和解析>>
科目: 来源: 题型:
【题目】Na2CO3溶液中存在平衡:CO32- + H2O![]() HCO3- + OH-,下列有关说法正确的是( )
HCO3- + OH-,下列有关说法正确的是( )
A.离子浓度:c(Na+) > c(CO32-) > c(OH-) > c(H+)
B.升高温度,平衡向逆反应方向移动
C.加入NaCl溶液,溶液的pH增大
D.加入NaOH固体,溶液的pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】向含![]() 明矾的溶液中加入含
明矾的溶液中加入含![]() 的溶液,下列说法正确的是
的溶液,下列说法正确的是![]()
![]()
A.该过程中先产生白色沉淀,后沉淀部分溶解,质量减少
B.当![]() 时,发生
时,发生![]()
C.当![]() 时,溶液中
时,溶液中![]() :
:![]() :
:![]()
D.当![]() 时,所得沉淀的物质的量达最大值
时,所得沉淀的物质的量达最大值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com