
科目: 来源: 题型:
【题目】根据下列实验操作和现象所做出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 相同条件下,浓度均为1mol·L1的CH3COOH和HCl分别做导电性实验,CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
B | 向浓度均为0.1 mol·L1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀 | Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
C | 分别向pH=3的盐酸和草酸溶液中加入足量锌粒,一段时间后草酸反应速率更快 | 草酸是二元酸 |
D | 室温下,用pH试纸测得:0.1 molL-1 Na2SO3溶液的pH为10;0.1 molL-1 NaHSO3溶液pH为5 | HSO |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】硒(Se)是第四周期ⅥA族元素,是人体内不可或缺的微量元素,其氢化物H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的基础原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=a kJ·mol1
2Se(s)+2H2O(l) ΔH1=a kJ·mol1
②2H2(g)+O2(g)= 2H2O(l) ΔH2=b kJ·mol1
反应H2(g)+Se(s)![]() H2Se(g)的反应热ΔH3=___________kJ·mol1(用含a、b的代数式表示)。
H2Se(g)的反应热ΔH3=___________kJ·mol1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是___________(填字母)。
a.气体的密度不变 b.υ(H2)=υ(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为液体H2Se,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释_________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如下图所示:
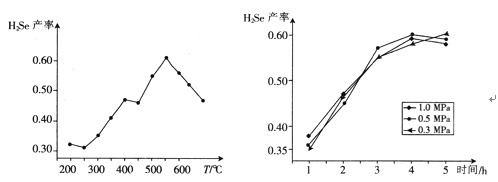
则制备H2Se的最佳温度和压强为______________________。
(3)已知常温下H2Se的电离平衡常数K1=1.3×104,K2=5.0×1011,则NaHSe溶液呈___________(填“酸性”或“碱性”),该溶液中的物料守恒关系式为____________________。
(4)用电化学方法制备H2Se的实验装置如下图所示:
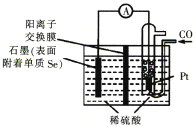
写出Pt电极上发生反应的电极反应式:_________________________________。
(5)H2Se在一定条件下可以制备CuSe,已知常温时CuSe的Ksp=7.9×1049,CuS的Ksp=1.3×1036,则反应CuS(s)+Se2-(aq)![]() CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
CuSe(s)+S2-(aq)的化学平衡常数K=________(保留2位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH 和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+基态核外电子排布式为________。
(2)SO4 2﹣的空间构型为_________(用文字描述),Cu2+与 OH-反应能生成[Cu(OH)4 ]2-, [Cu(OH)4]2-中的配位原子为_______(填元素符号)。
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
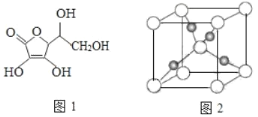
(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为_________。
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是___,该元素基态原子核外 M层电子的自旋状态_______(填“相同”或“相反”)。
(6)苯胺(![]() )的晶体类型是_________。苯胺与甲苯(
)的晶体类型是_________。苯胺与甲苯( ![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于水的电离平衡H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低
D.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是

A. 放电时,a电极反应为
B. 放电时,溶液中离子的数目增大
C. 充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D. 充电时,a电极接外电源负极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式错误的是()
A.用惰性电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.硫代硫酸钠与稀硫酸的反应:S2O32-+6H++2SO42-=4SO2↑+3H2O
C.醋酸钠溶液呈碱性的原因:CH3COO-+H2O![]() CH3COOH+OH-
CH3COOH+OH-
D.硫酸铜溶液遇到难溶的PbS转变为更难溶的CuS:Cu2++SO42-+PbS=CuS+PbSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作会使最终结果偏高的是( )
A.配制![]() 溶液,定容时俯视刻度线
溶液,定容时俯视刻度线
B.用![]() 盐酸滴定
盐酸滴定![]() 溶液,起始读数时仰视
溶液,起始读数时仰视
C.用湿润的pH试纸测定![]() 溶液的pH
溶液的pH
D.测定中和热的数值时,将![]() 溶液倒入盐酸后,立即读数
溶液倒入盐酸后,立即读数
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应3A(g)+B(g)![]() 2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g)+3D(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.9 mol·L-1·min-1B.v(B)=0.2mol·L-1·min-1
C.v(C)=0.5mol·L-1·min-1D.v(D)=1.0mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】以方铅矿(PbS)为原料制备铅蓄电池的电极材料的工艺流程如图所示: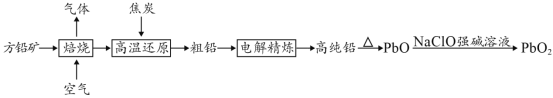
请回答下列问题:
(1)“焙烧”生成的气体直接排放可能造成的环境问题是____________,“焙烧”前须将方铅矿研磨粉粹的目的是________________________________。
(2)电解时,如c(Pb2+)远大于c(H+),则Pb2+优先于H+放电,工业上应用此原理可对铅进行电解精炼。“粗铅”的杂质主要有锌、铁、铜、银等,则阳极泥的主要成分为_________。
(3)写出制备PbO2的离子方程式________________________。
(4)已知部分含铅化合物的Ksp如下表所示:
物质 | PbCl2 | PbS |
Ksp | 1.2×10-5 | 9.0×10-29 |
①铅与稀盐酸反应产生少量气泡后反应终止,原因是_____________________。
②Pb(NO3)2是强酸弱碱盐,氢硫酸是弱酸[Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15],已知K>105时可以认为反应基本完全,通过计算判断向Pb(NO3)2溶液中通入H2S气体能否形成PbS沉淀___________________。(要求写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】食用香料A分子中无支链,B分子中无甲基,B能使Br2的CCl4溶液褪色,1mol B与足量Na反应生成0.5mol H2,各物质间有如图1转化。
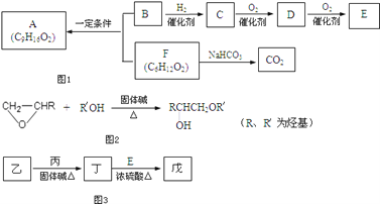
回答下列问题:
(1)在一定条件下能与C发生反应的是____;
a.Na b.Na2CO3 c.Br2/CCl4 d.CH3COOH
(2)D分子中的官能团名称是____,E的结构简式是____;
(3)B与F反应生成A的化学方程式是____;
(4)F的某种同分异构体甲能发生水解反应,其中的一种产物能发生银镜反应;另一产物在光照条件下的一氯取代物只有两种,且催化氧化后的产物也能发生银镜反应。则甲的结构简式是____;
(5)已知醇与某类环醚类之间在和固体碱共热的环境下会有如图2反应:从反应机理分析,该反应类型可称为____;
(6)工业上由乙出发可以合成有机溶剂戊(C7H14O3),流程图示见图3,
已知:①乙是C的同系物,其催化氧化产物在常温下为气态;②丁分子中有2个甲基,推测戊的结构简式是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com