
题目列表(包括答案和解析)
23.实验1 土壤酸碱性的测定
(1)测定土壤的酸碱性;
(4)①酸;
②不应用自来水而应用蒸馏水;
实验2 用不同改良剂进行土壤改良的对比实验
(4)①重过磷酸钙;
②相等;
实验3改良剂用量的测定实验
(2)略
(3)指导改良此土壤所用改良剂的量。
解析:实验1:实验的目的取决于实验的内容,所以实验目的为测定土壤的酸碱性;由PH<7,所以显酸性;自来水是混合物,在生产的过程中含有很多杂质,对实验容易产生影响,所以应用蒸馏水。
实验2:土壤应选择碱性物质来改良,所以重过磷酸钙不能用于改良此土壤的改良剂;为了实验的对比,实验所加水量的要求应该是相等的。
实验3:定量测定方法正确合理即可;作用对学生来讲是指导改良此土壤所用改良剂的量。
24(2008年黄冈市)通过一年的化学学习,我们认识了“酸”和“碱”,请回答下列问题:
(1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同的 离子(填符号),因此,它们有很多相似的化学性质,: 、 ……等(写二条即可)。
(2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥 等气体,氢氧化钙可由生石灰与水反应制得,化学方程式为: 。
(3)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为: 。
(4)5·12汶川大地震灾害发生后,为了灾区人民群众的饮用水安全,卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:
。
23.小东对某农田的土壤酸碱性和改良方案进行研究。请填空:
取样:如右图所示在农田的四点,各取耕作层土壤约1 kg,
让其自然风干,磨成粉状后混合均匀备用(以下称为土样)。
实验1 土壤酸碱性的测定
(1)实验目的: ;
(2)实验方法:取5g土样,放人碗底。加入自来水10mL,用玻璃棒充分搅拌均匀,待
其静置澄清后,用玻璃棒蘸取清液到精密pH试纸(可精确到小数点后一位)上,
即与标准比色卡比较,读出土样的pH;
(3)实验记录:进行二次实验,测得pH分别为:3.6、3.5、3.7;
(4)结果分析:
①从测定结果看,此土壤呈 (填“酸”或“碱”)性;
②此实验方法有一处不够严密,请给予指出并改正: ;
实验2 用不同改良剂进行土壤改良的对比实验
 (1)实验目的:研究不同改良剂对土样酸碱性的改变情况;
(1)实验目的:研究不同改良剂对土样酸碱性的改变情况;
(2)实验方法:取三份土样各500g,分别加入0.2g不同改良剂和约l L左右的水,充分搅拌静置后,测定清液的pH;
(3)实验记录:见右表
(4)结果分析:①从本实验结果看,不能用于改良此土壤的改良剂是 ;
②为增强对比实验的说服力,在上述实验方法中,你认为对每种改良剂进行实验所加水量的要求应该是 ;
实验3 改良剂用量的测定实验
|
加入的改良剂 |
重过磷酸钙 |
熟石灰 |
草本灰 |
|
有效成分化学式 |
Ca(H2PO4)2 |
Ca(OH)2 |
K2CO3 |
|
测得的pH |
3.1 |
10.3 |
4.1 |
(1)实验目的:研究使500g土样呈中性所需熟石灰的质量;
(2)实验方法:
(3)此实验结果的作用是: 。
22. 从左到右依次为CO2 NaOH HCl Fe CuSO4(该题答案不唯一,只要合理均给分)
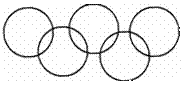
22.(2008年眉山市) “奥运在我心中”。整理归纳物质性质之间的相互联系是学习化学的一种有效方法。请你从学习过的单质、氧化物、酸、碱、盐中分别选一种代表物(不能重复选用),用化学式填写在下列的奥运标志五圆环中(两环相连表两种物质之间能相互发生反应)。
21.(1)能,因为红色褪去,说明溶液不再显碱性,氢氧化钠溶液与硫酸溶液发生了反应。
(2)氢氧化钠与硫酸是否恰好完全反应?(或硫酸是否过量;溶液呈中性还是酸性)。
生成的产物是什么?为什么酚酞在碱性溶液中变红?(注:答出2点即可)
解析:酸碱中和反应的实质是酸溶液中的H+和碱溶液中的OH-发生反应生成H2O的过程,在探究过程中,要大胆设想敢于创新。
21.物质科学课上,在氢氧化钠溶液与稀硫酸能否发生反应的实验中,小宇同学发现向氢氧化钠溶液中滴加几滴酚酞试液,溶液变红色,当向该溶液中连续滴加稀硫酸,溶液红色又褪去。
(1)根据实验现象,你认为氢氧化钠溶液与稀硫酸 (填“能”或“不能”)发生化学反应,理由是有 。
(2)针对上述实验,你还想探究的问题是有 。
20. KMnO4(或高锰酸钾)_ NaOH(或氢氧化钠)_BaCl2(或氯化钡) KNO3(或硝酸钾) 不能 此废液显碱性且含有毒的可溶性钡盐,会造成环境污染。
解析:①中废液为无色溶液,则溶液中不含有KMnO4(或高锰酸钾),因为其溶液显示红色;②中,废液显碱性,在可能含有的几种物质中,则一定含有碱性物质NaOH;③中向废液中加入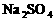 溶液,产生白色沉淀,说明生成了BaSO4,则废液中一定含有的物质是BaCl2(或氯化钡);从环境保护的角度考虑,此废液显碱性且含有毒的可溶性钡盐,会造成环境污染,因此不能直接倒入下水道。
溶液,产生白色沉淀,说明生成了BaSO4,则废液中一定含有的物质是BaCl2(或氯化钡);从环境保护的角度考虑,此废液显碱性且含有毒的可溶性钡盐,会造成环境污染,因此不能直接倒入下水道。
20.(2007 辽宁).在化学实验室,亮亮学习小组要对实验产生的废液进行研究。已知废液中可能含有 、
、 、
、 、
、 中的一种或几种。
中的一种或几种。
(1)小组同学进行了以下实验;
①首先,观察废液为无色溶液,则废液中一定不含有的物质是 ;
②然后,测试废液的pH为13,则废液中一定含有的物质是_ ;
③接下来,向废液中加入适量的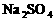 溶液,产生白色沉淀,则废液中一定还含有的物质是_ ,可能含有的物质是 。
溶液,产生白色沉淀,则废液中一定还含有的物质是_ ,可能含有的物质是 。
(2)小组同学从物质性质的角度分析:此废液 (填“能”或“不能”)直接倒入下水道,原因是 。
19.(1)> (2)2NaOH+H2SO4===Na2SO4+ 2H2O (3)A、C
19.(2008年重庆市)皮蛋是我国传统风味食品,制作皮蛋的方法有多种,一种制作含锌皮蛋的方法是把鸭蛋放在培养液中浸泡,培养液由水、食盐、氢氧化钠、少量硫酸锌等物质配制而成。
(1)取少量培养液于试管中,滴入无色酚酞溶液后变红,则培养液的pH 7(填“<”、“>”或“=”)
(2)在(1)的试管中滴加过量稀硫酸,红色褪去,发生反应的化学方程式为:
_____ 。
(3) 在(2)所得的溶液中加入一种盐溶液产生了沉淀,该盐可能是( )
A.BaCl2 B.CuSO4
C.AgNO3 D.KNO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com