
12.下表列出了钠的卤化物和硅的卤化物的熔点:
|
NaX |
NaF |
NaCl |
NaBr |
NaI |
|
熔点 |
995 |
801 |
775 |
651 |
|
SiX4 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
|
熔点 |
-90.2 |
-70.4 |
5.2 |
120.5 |
回答下列问题:
(1)钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,其原因是 。
(2)NaF 的熔点比NaBr的熔点高的原因是 。
SiF4 的熔点比SiBr4的熔点低的原因是 。
(3)NaF和NaBr的晶格能的高低顺序为 ,硬度大小为 。
11.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为
(用化学式表示)。
(2)写出锌和氢氧化钠溶液反应的化学方程式
。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是 。
① 硫酸铝和氢氧化钠 ② 硫酸铝和氨水 ③ 硫酸锌和氢氧化钠 ④ 硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式
。
试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因
。
10.(1)利用VSEPR推断分子或离子的空间构型
PO43-______________ ;CS2_______________ ;AlBr3(共价分子)_______________ 。
(2)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据下面给出的这两种微粒的球棍模型,写出相应的化学式:
 ________________;
________________; ___________________。
___________________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:
平面形分子____________,三角锥形分子____________,四面体形分子_____________。
9.极性分子易溶于极性分子中,而非极性分子易溶于非极性分子中,又叫相似相溶原理。PtCl2(NH3)2为平面正方形结构,它可以形成两种固体:一种为淡黄色,在水中溶解度小;另一种为黄绿色,在水中溶解度较大,请在以下空格中画出这两种固体分子的几何构型图:
淡黄色固体的分子构型 黄绿色固体的分子构型
黄绿色固体在水中的溶解度比淡黄色固体大的原因是
。
8.根据下列要求,各用电子式表示一实例:
(1)只含有极性键并有一对孤对电子的分子
(2)只含有离子键、极性共价键的物质
(3)只含有极性共价键、常温下为液态的非极性分子
7.氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
(1)写出(CN)2与苛性钠溶液反应的离子方程式_______________________________;
(2)已知氰分子中键与键之间的夹角为180°,并有对称性,
则(CN)2的电子式为____________,结构式为____________________________,
分子空间构型为_______________,是__________分子(填“极性”或“非极性”);
(3)氰分子中碳原子为___________杂化;一个氰分子中包含____________个σ键,_______个π键。
6.下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
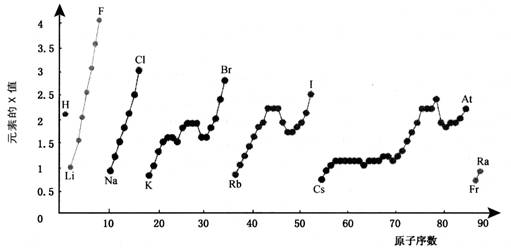
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
5.A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个电子。
(1)C原子的电子排布式为
(2)当n=2时,B的原子结构示意图为
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
4.下表是钠和镁的第一、二、三电离能(KJ·mol-1)。
|
元素 |
I1 |
I2 |
I3 |
|
Na |
496 |
4 562 |
6 912 |
|
Mg |
738 |
1 451 |
7 733 |
请试着解释:为什么钠易形成Na+,而不易形成Na2+?为什么镁易形成Mg2+,而不易形成Mg3+?
3.已知各种硝基苯酚的性质如下表
|
名称 |
结构式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
邻-硝基苯酚 |
 |
0.2 |
45 |
100 |
|
间-硝基苯酚 |
 |
1.4 |
96 |
194 |
|
对-硝基苯酚 |
 |
1.7 |
114 |
295 |
下列关于各种硝基苯酚的叙述不正确的是 ( )
A.邻-硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间-硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对-硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com