
19.(08年山东理综·11)下列说法正确的是C
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第族元素,Cs失电子能力比Na的强
D.P和As属于第族元素,H3PO4酸性比H3AsO4的弱
答案:C
解析:选项A中C与Si属于同主族元素,其氢化物的稳定性逐渐减弱,即CH4比SiH4稳定;选项B中O2-与F-的电子层结构相同,根据电子层相同,核电荷数小的,离子半径大,所以O2-半径大于F-半径;选项C中Na与Cs同主族,随着核电荷数的增大,原子失去电子的能力逐渐增强,即失去电子的能力:Cs>Na;选项D中根据同主族元素的最高价氧化物对应的水化物的酸性逐渐减弱,碱性逐渐增强,所以酸性:H3PO4>H3AsO4。
 20
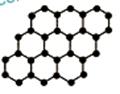
20 .(09年安徽理综·7)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
.(09年安徽理综·7)石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
 A.石墨烯与石墨互为同位素
A.石墨烯与石墨互为同位素
 B.0.12g石墨烯中含有6.02×1022个碳原子
B.0.12g石墨烯中含有6.02×1022个碳原子
 C.石墨烯是一种有机物
C.石墨烯是一种有机物
 D.石墨烯中的碳原子间以共价键结合
D.石墨烯中的碳原子间以共价键结合
 答案:D
答案:D
 解析:同位素的研究对象是原子,A选项错误;0.12g石墨烯的物质的量为0.01mol,所含碳原子个数为0.01NA,B选项错误;有机物一般含有碳、氢元素,C选项错误;由图示可知,石墨烯中碳原子间均为共价键结合,D选项正确。
解析:同位素的研究对象是原子,A选项错误;0.12g石墨烯的物质的量为0.01mol,所含碳原子个数为0.01NA,B选项错误;有机物一般含有碳、氢元素,C选项错误;由图示可知,石墨烯中碳原子间均为共价键结合,D选项正确。
18.(08年江苏化学·7)下列排列顺序正确的是B
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
答案:B
解析:①中O和F属于同周期元素,氢化物的稳定性:HF>H2O;②中Na和Mg为第三周期元素,原子半径:Na>Mg,而Mg比O多一个电子层,所以Mg>O;③P、S、Cl属于同周期元素,其酸性:HClO4>H2SO4>H3PO4。
17.(08年海南化学·1)HBr分子的电子式为A
A.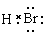 B.H+Br- C.
B.H+Br- C.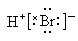 D.H-Br
D.H-Br
答案:A
解析:HBr分子的H原子和Br原子是以共用电子对形成的化合物,没有电子的转移,不存在离子。
16.(08年广东文基·68)O3和H2O2都是常见的氧化剂,下列有关说法错误的是A
A.O3和O2互为同位素
B.O3和H2O2的分子内都含有共价键
C.H2O2具有氧化性,可用于消毒杀菌
D.高空中的O3层保护保护人类免受紫外线的伤害
答案:A
解析:本题需要联系同位素、同素异形体的基本概念,化学键的类型,元素化合物的知识。较易,一般考生能断定A项为错误选项,同位素针对同种元素不同原子,同素异形体针对同种元素构成不同的单质,O3和02是由同种元素构成不同的单质,是互为同素异形体而不是互为同位素。其它选项可以暂不看,节省考试时间。
15.(08年广东理基·34)根据陈述的知识,类推得出的结论正确的是
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B.乙烯可使酸性高锰酸钾溶液褪色,则丙烯也可以使其褪色
C.CO2和SiO2 化学式相似,则CO2与SiO2的物理性质也相似
D.金刚石的硬度大,则C60的硬度也大
答案: B
解析: A. 钠在空气中燃烧生成Na2O2而非Na2O;
B. 具有重键的有机物和苯的同系物都可以使高锰酸钾溶液褪色;
C. CO2在常温下是气态,为分子晶体,低熔沸点;而SiO2在常温下是固态,为原
子晶体,高熔沸点;
D. C60是分子晶体,硬度小;而金刚石是原子晶体,硬度大。
14.(08年广东理基·27)根据表1信息,判断以下叙述正确的是C
表1 部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R
B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性
D.L2+与R2-的核外电子数相等
答案: C
解析: 由表可推知,L为Mg,M为Al,Q为Be,R为S,T为O。
A. 氢化物的沸点在同一主族中随最外层电子层数增多而升高,但水分子间具有氢
键,较为特殊,因此H2O的沸点高于H2S;
B. 金属性越强,单质与稀盐酸反应就越快,同一周期内金属性从上往下增强,因此
Mg>Be;
C. M、T形成的化合物为Al2O3,能与酸和碱反应生成对应的盐,是两性化合物;
D. L2+与R2-的最外层电子数相等,均为8个;但核外电子数不相等,Mg2+为10个,
S2-为18个。
13.(08年广东理基·26)下列有关原子结构和元素周期律表述正确的是C
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③
C.②④ D.③④
答案: C
解析: ① 原子序数为15的元素P位于VA族,最高化合价为+5;
② ⅦA族元素是同周期中非金属性最强的元素,IA族元素是同周期中金属性最强
的元素;
③ 第二周期ⅣA族元素为C,原子核电荷数和质子数一定为6,但中子数不一定
为6,不同中子数的原子称为同位素。
④原子序数为12的元素是Mg,位于元素周期表的第三周期ⅡA族,正确
12.(08年广东理基·25)下列化学用语正确的是D
A.Na2O2中氧元素的化合价为-2
B. 乙醇的分子式:CH3CH2OH

C.16S的结构示意图:
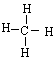 D.甲烷的结构式:
D.甲烷的结构式:
答案: D
解析:A. 氧元素在化合物中的化合价并非总是 ,在过氧化物中,氧的化合价为
,在过氧化物中,氧的化合价为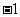 ,在超氧化物中,氧的化合价为
,在超氧化物中,氧的化合价为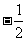 ;
;
B. CH3CH2OH是乙醇的结构简式而非分子式,其分子式为C2H6O;
C. 原子结构示意图中原子应该写成+16;
D. 该结构式为甲烷的结构式,正确。
11.(08年广东化学·13)元素X、Y和Z可结合形成化合物XYZ3;X、Y和Z的原子序数之和为26;Y和Z在同一周期。下列有关推测正确的是B
A.XYZ3是一种可溶于水的酸,且X与Y可形成共价化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ3
答案:B
解析:由题目可知,XYZ3可能的物质有:HClO3,NaNO3,MgCO3,AlBO3。若XYZ3为一种可溶于水的酸HClO3,XY(HO)不能形成共价化合物A错;若XYZ3为MgCO3微溶于水,可XZ形成离子化合物MgO,B正确;若XYZ3为NaNO3易溶于水的盐,YZ(NO)不是离子化合物,C错;若XYZ3离子化合物,YZ2为NO2,CO2均不是离子化合物,D错。
10.(08年广东化学·1)2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于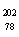 Pt的说法正确的是A
Pt的说法正确的是A
A.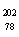 Pt和
Pt和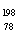 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素
B.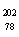 Pt和
Pt和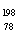 Pt的中子数相同,互称为同位素
Pt的中子数相同,互称为同位素
C.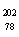 Pt和
Pt和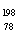 Pt的核外电子数相同,是同一种核素
Pt的核外电子数相同,是同一种核素
D.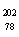 Pt和
Pt和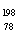 Pt的质量数不同,不能互称为同位素
Pt的质量数不同,不能互称为同位素
答案:A
解析:同位素定义:质子数相同,中子数不同的核素称为同位素。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com