
31.(09年海南化学·2)同一短周期的元素W、X、Y、Z的原子序数依次增加,下列叙述正确的是:
A.单质的化学活泼性:W<X<Y<Z B.原子最外层电子数:W<X<Y<Z
C.单质的氧化能力:W<X<Y<Z D.元素的最高化合价:W<X<Y<Z
答案:B
解析:本题中元素为同一周期,从左至右最外层电子数依次增加。而单质的活泼性分金属与非金属性,氧化能力随着单质晶体形态及分子内的化学键不同有变化,最高化合价随原子序数的递增有特例(O、F无正价)。
32 .(09年海南化学·10)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
.(09年海南化学·10)门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是:
 A.X单质不易与水反应 B.XO2可被碳或氢还原为X
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
 C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
答案:D
解析:根据元素周期律,同族元素随着原子序数的递增,非金属性减弱,气态氢化物的稳定性减弱。故D选项有明显错误。其他选项可由硅的性质进行类推。
30.(09年广东文基·62)碘单质及其化合物具有重要应用。下列说法正确的是
A.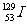 与
与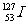 互为同位素
互为同位素
B.加碘食盐能使淀粉溶液变蓝
C.从海带中提取I2的过程只发生物理变化
D.I和Cl是同族元素,HI比HCl稳定
答案:A
解析: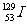 与
与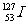 是I元素的不同核素,互为同位素,A选项正确;加碘食盐的碘是化合态的,不能使淀粉变蓝色,只有游离态的单质碘才能使淀粉变蓝色,故B选项错误;海带中的碘是化合态的,因此从海带中提取I2时要把化合态的转变为游离态的,价态发生变化,发生氧化还原反应,故C选项错误;I和Cl是同族元素,由于I的核电荷数比Cl多,因此Cl的非金属性比I强,所以HCl比HI稳定,故D选项错误。
是I元素的不同核素,互为同位素,A选项正确;加碘食盐的碘是化合态的,不能使淀粉变蓝色,只有游离态的单质碘才能使淀粉变蓝色,故B选项错误;海带中的碘是化合态的,因此从海带中提取I2时要把化合态的转变为游离态的,价态发生变化,发生氧化还原反应,故C选项错误;I和Cl是同族元素,由于I的核电荷数比Cl多,因此Cl的非金属性比I强,所以HCl比HI稳定,故D选项错误。
[考点分析]元素及其化合物性质;元素周期律的应用
29.(09年山东理综·11)元素在周围表中的位置,反映素的原子结构和性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期和的元素,最外层电子数,化学性质完全相同
D.同一主族的原子,最外层的化学原子相同
答案:B
解析:本题比较全面的考查了元素周期律的核心知识-“元素的结构”、“元素在周期表的位置”“、元素的性质”三者之间的关系。周期表中位于金属和非金属分界线的元素既有金属性又有非金属性,碳元素在遇到不同的物质反应时,既可表现为得到电子,也可能表现为失去电子;第三周期的元素从Na到Cl从正一价到正七价符合这一说法;H元素、Li元素形成离子后不能达到8电子稳定结构;同一主族的元素的原子,最外层电子数是相同的,但化学性质只能是相似,如第VIIA族的所有元素最外层都为7个电子,在化学反应中常表现为得电子,但的电子能力也是不一样的。再比如第IA族的所有元素最外层都为1个电子,但是H元素与Na元素性质差异很大。
28.(09年山东理综·10)下列关于氯的说法正确的是
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17若Cl为不同的核素,有不同的化学性质 学科
学科
C.实验室制备Cl2,可用排放和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
答案:C
解析:本题以氯元素为载体,从氧化还原、原子结构、收集方法不同角度进行考查,体现了山东理综化学选择题的命题模式。氯气与水的反应既是氧化剂也是还原剂;同一元素的不同核素化学性质几乎完全相同而物理性质不同;D中提Cl2的体积未指明是标准状况。实验室制备Cl2,可用排饱和食盐水集气法收集也可用瓶口向上排空气法收集,故C正确。
26.(09年江苏化学·2) 下列有关化学用语使用正确的是
下列有关化学用语使用正确的是
A.硫原子的原子结构示意图:
B.NH4Cl的电子式: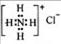
C.原子核内有10个中子的氧原子:
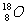
 D.对氯甲苯的结构简式:
D.对氯甲苯的结构简式: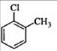
 答案:C
答案:C
 解析:A项,硫原子的原子结构示意图应为
解析:A项,硫原子的原子结构示意图应为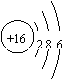
 ,
, 所以A项错误。B项,NH4Cl是由MH4+和Cl-离子构成,由于Cl-是阴离子,必须写出电子式,
所以A项错误。B项,NH4Cl是由MH4+和Cl-离子构成,由于Cl-是阴离子,必须写出电子式, 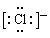 。
。
 C项,
C项, 表示质量数为18,质子数为8的氧原子,所以该原子核内有10个中子。
表示质量数为18,质子数为8的氧原子,所以该原子核内有10个中子。
 D项,该结构简式是邻氯甲苯,因为氯原子和甲基的位置在相邻的碳原子上。对氯甲苯中的氯原子和甲基的位置应该处于相对位置。
D项,该结构简式是邻氯甲苯,因为氯原子和甲基的位置在相邻的碳原子上。对氯甲苯中的氯原子和甲基的位置应该处于相对位置。
 [考点分析]
[考点分析]
 ①熟记1-20号原子的原子结构结构示意图,常见阴离子、阳离子的结构示意图;
①熟记1-20号原子的原子结构结构示意图,常见阴离子、阳离子的结构示意图;
 ③质量数、质子数、中子数之间的关系;、
③质量数、质子数、中子数之间的关系;、
 ④常见有机物的命名。
④常见有机物的命名。
27 .(09年江苏化学·8)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
.(09年江苏化学·8)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
 A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
 B.元素X不能与元素Y形成化合物X2Y2
B.元素X不能与元素Y形成化合物X2Y2
 C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
 D.元素W、R的最高价氧化物的水化物都是强酸
D.元素W、R的最高价氧化物的水化物都是强酸
 答案:C
答案:C
 解析:从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Mg元素,R是S元素。所以,A项,Y、Z、W具有相同电子层结构的离子(O2-、Na+、Mg2+),其半径依次减小(判断依据:核外电子排布相同的微粒,半径随着核电荷数的增加而减小);B项,X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2);C项,元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:XmY>XmR;W元素最高价氧化物的水化物是Mg(OH)2,是中强碱,而R元素最高价氧化物的水化物是H2SO4,是强酸。
解析:从题目所给的条件可以看出X是H元素,Y是O元素,Z是Na元素,W是Mg元素,R是S元素。所以,A项,Y、Z、W具有相同电子层结构的离子(O2-、Na+、Mg2+),其半径依次减小(判断依据:核外电子排布相同的微粒,半径随着核电荷数的增加而减小);B项,X和Y元素能形成2种化合物,X2Y(H2O)和X2Y2(H2O2);C项,元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:XmY>XmR;W元素最高价氧化物的水化物是Mg(OH)2,是中强碱,而R元素最高价氧化物的水化物是H2SO4,是强酸。
 [考点分析]元素周期律的运用
[考点分析]元素周期律的运用
 ①同周期、同主族内元素性质(核外电子排布、原子半径、金属性、非金属性、酸碱性、气态氢化物的热稳定性等)变化规律。
①同周期、同主族内元素性质(核外电子排布、原子半径、金属性、非金属性、酸碱性、气态氢化物的热稳定性等)变化规律。
 ②元素之间化合所形成化合物的化学式的书写。
②元素之间化合所形成化合物的化学式的书写。
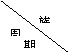
25.(09年广东理基·35)下表是元素周期表的一部分,有关说法正确的是
 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
2 |
|
|
|
c |
|
d |
|
|
3 |
a |
b |
|
|
|
e |
f |
A.e的氢化物比d的氢化物稳定
B.a、b、e三种元素的原子半径:e>b>a
C.六种元素中,c元素单质的化学性质最活泼
D.c、e、f的最高价氧化物对应的水化物的酸性依次增强
答案:D
解析:根据同周期和同主族性质的递变规律可以判断各选项的正误。A选项e、d元素同主族,且d在第二周期,而e在第三周期,因此d的氢化物比e的氢化物稳定。B选项中a、b、e三种元素同周期,所以其原子半径为a>b>e。这六中元素的单质中c的单质碳石化学性质最不活泼的。
24.(09年广东理基·28)下列说法正确的是
A.MgSO4晶体中只存在离子键
B.含Ca2+、Mg2+的水都是硬水
C.雾是气溶胶,在阳光下可观察到丁达尔效应
D.玻璃是氧化物,成分可表示为Na2O·CaO·6SiO2
答案:C
解析:MgSO4晶体中除存在离子键外,还在SO42-离子中存在共价键,故A选项错误。硬水是指含有Ca2+、Mg2+较多的水,因此B选项错误。雾是是一种胶体,属于气溶胶,因此在阳光下可观察到丁达尔效应,C选项正确。玻璃是一种硅酸盐制品,虽然可以用氧化物的形式表示为Na2O·CaO·6SiO2,但是并不说明就是氧化物,故D选项错误。
23.(09年广东理基·19)下列化学用语使用不正确的是
A.Na+的结构示意图
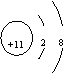

B.纯碱的化学式为Na2CO3
C.聚乙烯的结构简式为CH2=CH2
D.高氯酸(HCIO4)中氯元素的化合价为+7
答案:C
解析:聚乙烯的结构简式应为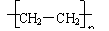
 ,CH2=CH2
,CH2=CH2 表示的聚乙烯的单体乙烯的结构简式,
表示的聚乙烯的单体乙烯的结构简式,
22.(09年广东化学·11)元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
答案:B
解析:由题目信息可推断出,X为Na ,Y为Cl,Z为O。同周期(第三周期中)X(Na)的金属性最强,A正确;同周期元素从左向右原子半径减小,原子半径X(Na)>Y(Cl),电子层结构相同的离子,离子半径随核电荷数的增加而减小,离子半径X(Na+)<Z(O2-),B错误;同族元素中(VIA族)Z(O)的氢化物稳定性最高,C正确;同周期(第三周期中)Y(Cl)的非金属性最强,则最高价含氧酸的酸性最强(HClO4),D正确。
21.(09年广东化学·1)我国稀土资源丰富。下列有关稀土元素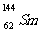 与
与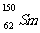 的说法正确的是
的说法正确的是
A.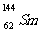 与
与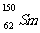 互为同位素
互为同位素
A.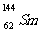 与
与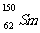 的质量数相同
的质量数相同
A.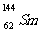 与
与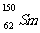 是同一种核素
是同一种核素
A.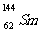 与
与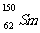 的核外电子数和中子数均为62
的核外电子数和中子数均为62
答案:A
解析:质子数相同,中子数不同的核素称为同位素,具有一定数目质子数和中子数的原子成为核素。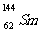 与
与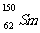 质量数不同,B错;
质量数不同,B错;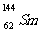 与
与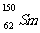 是不同核素,C错;
是不同核素,C错;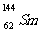 与
与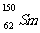 的中子数不同,D错。
的中子数不同,D错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com