
1.(2008福建文、理)某班级要从4名男生和2名女生中选派4人参加某次社区服务,如果要求
至少有1名女生,那么不同的选派方法有( )
A.14 B.24 C.28 D.48
3. 可以用分液漏斗分离的一组液体混合物是(C)
A. 溴和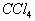 溶液 B. 苯和溴苯
溶液 B. 苯和溴苯
C. 水和硝基苯 D. 苯和汽油
2. 下面两种有机物,选用一种试剂鉴别
甲苯与己烷(酸性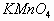 )
)
苯与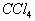 (水)
(水)
在有机物的分离或除杂中,有些直接可以通过萃取分液、蒸馏分馏、水洗气洗等操作就能顺利解决,有时还往往需要加入其他试剂,加入的试剂一般只和杂质反应(或者只和非杂质反应,而杂质却不反应),最后不能引进新杂质,且试剂易得,杂质易分。如怎样分离硝基苯与混酸(加入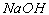 溶液)、乙酸乙酯与乙酸(饱和
溶液)、乙酸乙酯与乙酸(饱和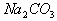 溶液)、甲烷和乙烯(用溴水)、酒精和水(新制
溶液)、甲烷和乙烯(用溴水)、酒精和水(新制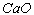 ,蒸馏)等等。又例:怎样分离苯、苯甲酸和苯酚?方法:加入
,蒸馏)等等。又例:怎样分离苯、苯甲酸和苯酚?方法:加入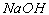 溶液,通过分液先得到苯,余下溶液是苯甲酸钠和苯酚钠,再加入
溶液,通过分液先得到苯,余下溶液是苯甲酸钠和苯酚钠,再加入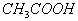 分液得到苯酸,最后在苯甲酸钠中加入
分液得到苯酸,最后在苯甲酸钠中加入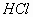 ,得到了苯甲酸。
,得到了苯甲酸。
练习:
1. 选用恰当的试剂和方法除去杂质。
溴乙烷中混有乙醇(水)(分液)
乙醇中混有乙酸(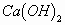 )(蒸馏)
)(蒸馏)
2. 题型
(1)不加任何试剂的鉴别题 一般先根据物理性质(颜色、状态、气味以及溶解性等等),确定一种(或几种)物质,再用已检出的物质继续鉴别。或者利用相互之间反应后产生的现象不同,各个突破。
(2)限用一种试剂利用所加试剂能与多种物质的反应(或虽不反应但出现与众不同的现象)逐一加以鉴别。例:仅用一种试剂即可将酒精、苯酚溶液、己烯、甲苯等四种无色液体区分开来,这种试剂可以是(B)
A. 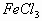 溶液 B. 溴水
溶液 B. 溴水
C. 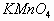 溶液 D. 金属钠
溶液 D. 金属钠
(3)不限任何试剂 这种情况下,只要能熟练掌握每种类别(或物质)的鉴别方法或者特征反应就能顺利进行。例:如何鉴别以下三种物质:乙醇、乙醛、乙酸。根据各自特点可以分别用饱和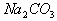 溶液与新制
溶液与新制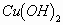 来检出。
来检出。
1. 检验与鉴别的常用方法
(1)根据溶解性的情况,大部分有机物都不溶于水,如酯类物质、苯、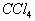 等,而少数物质却易溶于水(或任意比互溶)如:乙醇、甘油、乙醛,因此用水即能检出。
等,而少数物质却易溶于水(或任意比互溶)如:乙醇、甘油、乙醛,因此用水即能检出。
(2)依据有机物的密度大小。如硝基苯与苯、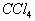 与酯类物质等等。
与酯类物质等等。
(3)依据燃烧的现象不同,如能否燃烧、是否产生浓烟(烷烃烯烃炔烃之间的区别)、是否伴有气味(纤维素、蛋白质、塑料等的区别)等等。
(4)检查有机物的官能团:如�CHO,用银氨溶液来检验,烯烃中的双键用加溴水褪色的方法来检验。
(5)特征反应:如淀粉遇碘变蓝;酚类中加入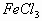 变紫色。
变紫色。
35. (09年福建理综·23)(15分)
(09年福建理综·23)(15分)

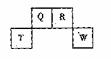 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,期中T所处的周期序数与主族序数相等,请回答下列问题:
 (1)T的原子结构示意图为 。
(1)T的原子结构示意图为 。
 (2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
(2)元素的非金属性为(原子的得电子能力):Q W(填“强于”或“弱于”)。
 (3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
 (4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
 (5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氯气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是 。
 (6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量akJ和bkJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的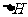 =
(注:题中所设单质均为最稳定单质)。
=
(注:题中所设单质均为最稳定单质)。
答案:(1) (2)弱于
(2)弱于
(3)S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2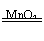
 2H2O+O2↑(或其他合理答案:)
2H2O+O2↑(或其他合理答案:)
(5)NaNO2
(6)(3a – 4b)kJ/mol
解析:本题考查无机物的性质,涉及化学用语、方程式书写、氧化还原反应以及热化学的知识。从给出的表,结合T在周期表的位置与族数相等这一条件 ,不难得出T为Al,Q为C,R为N,W为S。(1)T为Al,13号元素。(2)S、C最高价氧化物对应的酸为硫酸强于碳酸,则可得非金属性S强于C。(3)S与H2SO4发生归中反应,从元素守恒看,肯定有水生成,另外为一气体,从化合价看,只能是SO2。(4)比R质子数多1的元素为O,存在H2O2转化为H2O的反应。(5)N中相对分子质量最小的氧化物为NO,2NO+O2=2NO2,显然NO过量1L,同时生成1L的NO2,再用NaOH吸收,从氧化还原角度看,+2价N的NO与+4价N的NO2,应归中生成+3N的化合物NaNO2。(6)C +O2 CO2△H=-a kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2
CO2△H=-a kJ/mol①,4Al+3O2=2Al2O3△H= -4bkJ/mol②。Al与CO2的置换反应,写出反应方程式为:4Al+3CO2 3C+2Al2O3,此反应的△H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol。
3C+2Al2O3,此反应的△H为可由②-①×3得,△H=-4b-(-3a)=(3a-4b)kJ/mol。
36 .(09年天津理综·7)(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
.(09年天津理综·7)(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为 。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
。
 (4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
_。
(4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
_。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

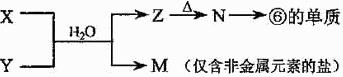
 X溶液与Y溶液反应的离子方程式为
,
X溶液与Y溶液反应的离子方程式为
, N→⑥的单质的化学方程式为
。
N→⑥的单质的化学方程式为
。
 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
。
常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
。
答案:(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3 (3)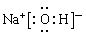 或
或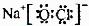 (4)a b
(4)a b
(5)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融)
 4Al+3O2↑ 溶液的pH等于7
4Al+3O2↑ 溶液的pH等于7
解析:本题以周期表为题材,考查原子半径比较,酸性强弱,电子式,离子方程式以及盐类水解等知识。(1)⑤⑥位于同一周期,且⑤排在⑥的前面,原子半径大,而④在上一周期,比⑤、⑥少一个电子层,故半径最小。(2)②⑦位于同一主族,上面的非金属性强,最高价含氧酸酸性强,②③位于同一周期,且③在后,非金属性强,对应的酸性强。(3)四种元素分别为氢、氧、钠和氯,离子键显然必须是钠盐,极性共价键则应有两种非金属组成。(4)液态H2O2可以在MnO2、FeCl3等催化剂作用下发生分解反应。(5)⑥为Al,可推断Z为Al(OH)3,受热分解可产物Al2O3,再电解即可得单质铝。M仅含非金属的盐,显然铵盐,所以X与Y应为AlCl3与NH3·H2O的反应,生成NH4Cl。由于NH4+ 水解,故要使其浓度与Cl-相等,则要补充NH3·H2O。由电荷守恒知:c(NH4+ )+ c(H+) c(Cl-)+c(OH-),若c(NH4+ )
c(Cl-)+c(OH-),若c(NH4+ ) c(Cl-),则c(H+)= c(OH-),即pH=7。
c(Cl-),则c(H+)= c(OH-),即pH=7。
14.(8分)(1)7 在K2O、K2O2、KO2、KO3中任选2个 (2)He、Ne、Ar
(3)C、H (4)Na (5)NH3 SiH4
解析:本题考查了元素周期表和元素周期律的知识,侧重考查学生运用所学知识解决问题的能力。(1)1-20号的金属元素有:Li、Be、Na、Mg、Al、K、Ca。(3)有机物的种类在化合物中占的比例最大,且C、H还能组成无机物。(5)由同一周期从左到右非金属性逐渐增强可知非金属性:N>C,由同一主族从上到下非金属性逐渐减弱可知非金属性:C>Si,所以非金属性:N>Si。又由非金属性越强其氢化物的稳定性也越强可知稳定性:NH3>SiH4。
34.(8分)(08年海南化学·14)根据元素周期表1-20号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧反应生成的化合物有___________(填两种化合物的化学式)。
(2)属于稀有气体的是___________(填元素符号,下同)。
(3)形成化合物种类最多的两种元素是____________________。
(4)第三周期中,原子半径最大的是(稀有气体除外)______________。
(5)推测Si、N最简单氢化物的稳定性_________大于_________(填化学式)。
33.(10分)(2007海南·13)下表为元素周期表的一部分,请回答有关问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是 和 ;
(2)表中最活泼的金属是 ,非金属最强的元素是 ;
(填写元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
, ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
。
答案:(1)Si Ar(2)K F
(3)铝(或Al)2Al(OH)3 + 3H2SO4=Al2(SO4)3 + 6H2O
Al(OH)3 + KOH=KAlO2 +2H2O
(4)在NaBr溶液中通入氯气(或加入氯水),溶液变红棕色(或橙色)
考点:本题考查了元素周期表的应用以及常见元素的性质。
解析:(1)根据元素周期表,可确定①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩元素分别为:N、F、Mg、Al、Si、S、Cl、Ar、K、Br。(2)又知金属性:同周期从左到右越来越小,同主族从上到下越来越大;而非金属性:同周期从左到右越来越大,同主族从上到下越来越小。(3)氢氧化铝为两性化合物,既能与酸反应,又能与碱反应。(4)利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,设计反应Cl2 + 2NaBr=2NaCl+Br2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com