
科目: 来源: 题型:
【题目】下列关于晶体的说法一定正确的是( )
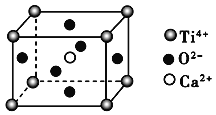
(CaTiO3的晶体结构模型(Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
A. 分子晶体中都存在共价键
B. CaTiO3晶体中每个Ti4+与12个O2-相紧邻
C. SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D. 金属晶体的熔点都比分子晶体的熔点高
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A.2.0gCO2与SO2的混合气体分子中,含有的质子数为NA
B.7.1gCl2与100mL1.0mol·L-1NaOH溶液反应,转移电子数为0.1NA
C.17gNH3与48gO2在催化剂作用下充分反应,得到NO分子数为NA
D.标准状况下,2.24LCH4和C3H6混合气体中,含有极性键数为0.5NA
查看答案和解析>>
科目: 来源: 题型:
【题目】A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
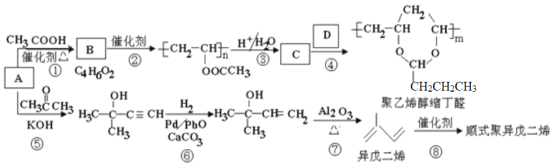
回答下列问题:
(1)A的名称是___,B中含有的官能团是___。
(2)①的反应类型是___,⑦的反应类型是___。
(3)C和D的结构简式分别为___、___。
(4)异戊二烯分子中最多有___个原子共平面,顺式聚异戊二烯的结构简式为___。
(5)写出与A具有相同官能团的异戊二烯的所有同分异构体___(填结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学探究 Cu 与 NO 的反应,查阅资料:①Cu 与 NO 反应可生成 CuO 和 N2,②酸性条件下,NO 或 NO2–都能与 MnO4–反应生成 NO3–和 Mn2+
(1)实验室利用Cu和稀 HNO3 制备 NO,写出反应的化学方程式____。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
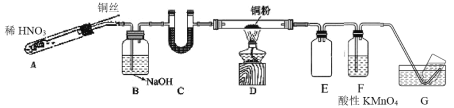
①使用铜丝的优点是____装置 E 的作用为____。
②装置 C 中盛放的药品可能是____;
③装置 D 中的现象是____;装置 F 中反应的离子方程式是____。
(3)测定NaNO2 和 NaNO3混合溶液中NaNO2的浓度。取 25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1 酸性 KMnO4 溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 KMnO4 溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是____(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.因为没有一直观察锥形瓶中溶液颜色变化,判断滴定终点时溶液已变红d.酸性 KMnO4 溶液中含有其他氧化性试剂e.锥形瓶洗净后用待测液润洗
②酸性 KMnO4溶液滴定亚硝酸钠溶液的离子方程式为____。
③NaNO2的物质的量浓度为____
查看答案和解析>>
科目: 来源: 题型:
【题目】新型冠状病毒引起了全世界的关注。国外顶级医学期刊《新英格兰医学杂志》在 2020年1月31号报道称:美国首例新型冠状病毒(2019-nCoV)感染患者,在住院第7天开始使用药物Remdesivir(瑞德西韦)治疗,经治疗后发烧症状消失,咳嗽减轻,病情明显好转!Remdesivir(瑞德西韦)的初步治疗效果引起了我国的高度重视。发现中间体 K 是合成该药物的关键中间体。
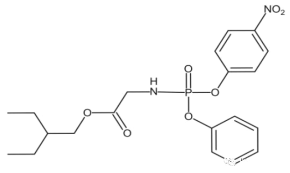
药物瑞德西韦(Remdesivir))对2019年新型冠状病毒(2019-nCoV)有明显抑制作用;K为药物合成的中间体,其合成路线如下:
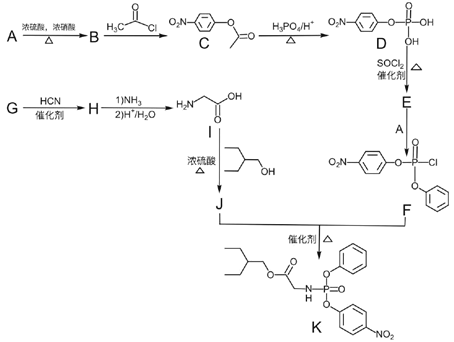
已知:
Ⅰ.R—OH![]() R—Cl
R—Cl
Ⅱ. ![]()
![]()
![]()
![]()
![]()
![]()
![]()
回答下列问题:
(1)B的化学名称为______________。
(2)J中含氧官能团的名称为________。
(3)B到C的反应类型__________。
(4)由G生成 H 的化学反应方程式为_______。
(5)E中含两个Cl原子,则 E 的结构简式______________。
(6)X是C同分异构体,写出满足下列条件的X的结构简式__________
①苯环上含有硝基且苯环上只有一种氢原子
②遇 FeCl3溶液发生显色反应
③1mol 的 X 与足量金属 Na 反应可生成 2g H2
(7)设计由苯甲醇为原料制备化合物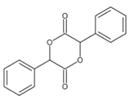 的合成路线__________ (无机试剂任选)。
的合成路线__________ (无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢、氮、氧、硫、镁、铁、铜、锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断 Mg 基态原子的核外电子排布为,![]() 该同学所画的电子排布图违背了____
该同学所画的电子排布图违背了____
(2)Cu 位于____族____区,Cu+价电子排布式为____。
(3)MgCO3的分解温度____ BaCO3(填“>” 或、“<”)
(4)Ge、As、Se 元素的第一电离能由大到小的顺序为____
(5)已知 H3BO3 是一元酸,1molH3BO3 在水中完全电离得到的阴离子中含有σ键的数目为____
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2 与 CO2 的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 ,原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体 Cu 的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NH4Cl溶液中存在如下平衡:NH4+(aq)+H2O(l)![]() NH3·H2O(aq)+H+(aq),△H>0,回答下列问题:
NH3·H2O(aq)+H+(aq),△H>0,回答下列问题:
(1)向溶液中加入Zn粉,平衡___移动(填“正向”,“逆向”或“不”),可能出现的现象是__。
(2)升高温度,H+的浓度___(填“增大”,“减小”或“不变”),平衡___移动(填“正向”,“逆向”或“不”)。
(3)增大压强,平衡___移动(填“正向”,“逆向”或“不”),反应速率___(填“增大”,“减小”或“不变”)。
(4)该反应平衡常数的表达式为___,保持温度不变再加入NH4Cl(aq),平衡常数___(填“增大”,“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com